роботи відбувається в еквівалентних кількостях,
тобто в любому термодинамічному процесі кількість енергії, переданої в формі тепла дорівнює
кількості енергії, яка виникла в формі роботи:
V тобто q - ∆U = l
В термодинамічних розрахунках часто розглядають добуток Р·V – яке називають потенційною енергією тиску.
Сума внутрішньої енергії U і добутку Р·V називають ентальпією - і
і = U + P·V , дж/кг
Для ідеального газу ентальпії залежить тільки від температури і визначається так: і = СР·T , дж/кг.
3. Термодинамічні процеси зміни стану ідеального газу.
Вивчення термодинамічного процесу є визначення роботи, яка здійснилась при зміненні параметрів робочого тіла, або змінення внутрішньої енергії та встановлення зв’язку між окремими параметрами стану (тиском, температурою, питомим об’ємом і ентальпією).
Розпізнають 5 видів процесів: ізохорний, ізобарний, ізотермічний, адіабатний і політропний.
@Ізохорний процес здійснюється при V = Const.
Виходячи з рівняння Клайперона ( P·V = R·T), при V = Const матимемо:
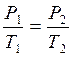 - закон Шарля
- закон Шарля
Вся підведена теплота перетворюються на збільшення внутрішньої енергії. Робота дорівнює нолю.
@ ![]()
![]() Ізобарний процес Р = Const,
тоді:
Ізобарний процес Р = Const,
тоді:
![]()
![]() Р
Р
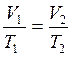 - закон Гейлюсака.
- закон Гейлюсака.
В ізобарному процесі одночасно з нагрівом
відбувається розширення газу. В цьому
випадку лише незначна частка йде на
здійснення роботи ,
приблизно 28,5%, а 7,5% V
71,5% на змінення внутрішньої
енергії.
@ Ізотермічний процес Т = Const, тоді:
Р1·V1 = P2·V2 – закон Бойля-Моріота
Здійснить такий процес практично дуже важко ( втрати тепла відбуваються).Робота визначається за формулою:
L =2,3R·T·lg·![]()
@ Адіабатний процес – процес, який здійснюється без обміну з зовнішнім середовищем. Можливе виконання при дуже швидкому процесі.
Рівняння адіабати буде мати вигляд: P·Vk = Const, де k – коефіцієнт адіабати.
Під час здіснення адіабатного процесу відбувається швидке змінення тиску. Зовнішня робота здійснюється за рахунок змінення внутрішньої енергії газу. Робота визначається за формулою:
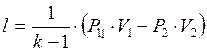
@ Політропний процес – багатообразний термодинамічний процес описується рівнянням: Р·Vn = Const, де n – показник політропи. Формули для визначення роботи аналогічні як і при адіабатному процесі тільки показник політропи – n.
4. 2Й закон термодинаміки.
1 – й закон термодинаміки говорить про перетворення енергії, але не дозволяє вирішить питання про можливість та напрямок здійснення термодинамічного процесу. Але це питання має велике практичне значення.
Достатньо легко роботу перетворити в теплоту ( наприклад тертя, стиснення), і навпаки, теплоту перетворити на роботу складніше. Зворотний процес потребує додаткових затрат енергії із зовні. Тепло легко переходить від гарячого тіла до холодного, а навпаки потрібно витрачати додатково енергію.
Всі ці особливості роз’яснює 2- й закон термодинаміки, який сформулював вчений Карно так:
всюди де є різниця температури можливе виникнення рушійної сили і величина її залежить тільки від різниці температур тіл між якими відбувається обмін теплом.
Розглядають функцію s – функція стану газу, яка має назву ентропія. Змінення ентропії зворотних процесів записують так:
ds =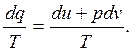
Змінення ентропії залежить тільки від початкового і кінцевого стану газу і не залежить від процесу, згідно якого змінюється цей стан.
5. T-s діаграма.
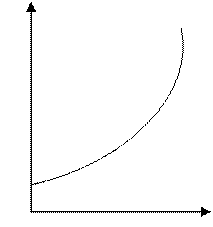 Так
як кожному стану тіла або системі тіл відповідає своє значення температури Т і
ентропії s, то кожний рівновісний стан його можливо
відобразить графічно крапкою, а зворотній процес зміни стану – кривою. Якщо в
прямокутній системі координат на вісі абсцис відложити значення ентропії s , а на вісі ординат - значення температури Т, то в загальному вигляді
зворотне змінення стану 1 кг робочого тіла можливо відобразити деякою кривою.
Площа є значення теплоти dq, яке підведено або відведено від газу.
Так
як кожному стану тіла або системі тіл відповідає своє значення температури Т і
ентропії s, то кожний рівновісний стан його можливо
відобразить графічно крапкою, а зворотній процес зміни стану – кривою. Якщо в
прямокутній системі координат на вісі абсцис відложити значення ентропії s , а на вісі ординат - значення температури Т, то в загальному вигляді
зворотне змінення стану 1 кг робочого тіла можливо відобразити деякою кривою.
Площа є значення теплоти dq, яке підведено або відведено від газу.
А площа під кривою дорівнює кількості теплоти процесу відображеного кривою. І тому діаграму Тs називають „тепловою”.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.