Охтирський технікум СНАУ
ЛЕКЦІЯ № 2
(Тематична)
Навчальна дисципліна – ГКА.
Тема лекції: Робоче тіло та параметри його стану. Теплоємкість.
Термодинамічні процеси зміни стану ідеального газу.
Для студентів ІІІ курсу, спеціальність 5. 092123.
Тривалість – 65 хв.
План
викладення лекційного матеріалу
1. Робоче тіло та основні параметри його стану.
2. Теплоємкість. 1Й закон термодинаміки.
3. Термодинамічні процеси зміни стану ідеального газу.
4. 2Й закон термодинаміки.
5. T-s діаграма.
Викладач: Пугачов О.О.
Розглянуто і схвалено на засіданні предметної циклової
комісії спеціальних дисциплін (спеціальність 5. 092123)
протокол №від „ „ 2004 р.
Голова циклової комісії Пугачов О.О.
1. Робоче тіло та основні параметри його стану
Як відомо робота, або енергія передається за допомогою якогось тіла. В енергетичних установках обов’язково існує так зване робоче тіло – це речовина, яка здатна сприймати тепло й , розширюючись здійснювати роботу. В більшості випадків це газ або пара.
Для простоти вивчення властивостей газоподібного робочого тіла вводять поняття – ідеальний газ. Це такий уявний газ в якому молекули розглядаються як матеріальні крапки , між якими немає сил тяжіння. (Тобто маса є, а об’єму нема). І тому можливо розрахунки вести за формулами ідеального газу.
Для того щоб працювати з робочим тілом необхідно знати основні його параметри. До основних параметрів робочого тіла відносять: тиск –Р, температуру – Т та питомий об’єм – ν.
@ Тиск (Рман) це величина ударів хаотично рухаючихся молекул ідеального газу, яку сприймають стінки замкнутого об’єму. В системі СІ тиск вимірюють в Паскалях (Па). 1Па = 1н/м2. Величина цього тиску порівняно незначна. На практиці іноді користуються внесистемними одиницями – кГс/см2 (атмосфера), мм. водяного або ртутного стовпчика. Для порівняння – 1атм = 9,8·104 Па., 1 мм вод. ст. = 9,8 Па.
Потрібно враховувати і те, що навколо земної кулі існує також газ, який також створює відповідний тиск, його називають тиском атмосфери (Рбар). І тоді абсолютний тиск визначиться за формулою:
Рабс. = Рман + Рбар
@ Температура (Т), це величина середньої кінетичної енергії руху молекул газу. В системі СІ вимірюється в градусах Кельвіна (ºК). Прилади, якими вимірюють температуру, проградуйовані в градусах Цельсія (ºС). 0ºК= -273ºС.
@ Питомий об’єм (v), це об’єм, який займає одиниця маси газу. В системі СІ вимірюється він в м3/кг, зворотна величина – щільність.
2. Теплоємність 1й закон термодинаміки.
Для визначення кількості тепла, яке утримує або віддає робочи тіло, під час змінення його температури введено поняття теплоємкості – це співвідношення кількості тепла, яке отримало (втратило) тіло до змінення його температури. Позначається теплоємкість буквою С.
Зручніше розглядати питому теплоємкість, тобто віднесену до кількості речовини. Кількість газу можливо визначити в масі (кг), в об’ємі (м3) або в молях. І тому питому теплоємкість розпізнають як масову, об’ємну і мольну.
Значення теплоємкості любого ідеального газу залежить від характеру процесу який відбувається в цьому газі, тобто тепло можливо підводити при постійному об’ємі V, або при постійному тиску Р.
Теплоємкість при постійному об’ємі (СV), і теплоємкість при постійному тиску (СР).
Крім того СР > СV , а співвідношення 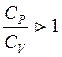 і є
показником адіабати – k, який залежить від атомності газу, а СР-СV
= R.
і є
показником адіабати – k, який залежить від атомності газу, а СР-СV
= R.
Перетворення тепла в роботу супроводжується зміненням стану робочого тіла, яке відбувається внаслідок взаємодії з навколишнім середовищем. Взаємодія можить проявлятися:
- в підводі тепла або відводі його в навколишнє середовище;
- в подоланні робочим тілом зовнішніх сил ( стиснення газу або його розширення – здійснення роботи).
Якщо процес відбувається без змінення об’єму робочого тіла , то робота дорівнює 0. Змінення стану робочого тіла називається термодинамічним процесом. Цей процес може бути рівновісним і нерівновісним. Рівновісний процес протікає повільно, він ще називається зворотнім процесом. Але всі реальні процеси не зворотні - тому що маються втрати (тертя і т.п.).
Наглядно термодинамічний процеси розглядаються в вигляді графіків (діаграм). Найпростіша Р-V діаграма .
 Відповідно до закону збереження енергії по
Відповідно до закону збереження енергії по
Ломоносову: енергія не створюється і не виникає ні з
Р чого, вона лише переходить з одного виду в інший.
На основі цього твердження існує 1-й закон термодинаміки.
Який виголошується так: взаємне перетворення тепла і
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.