

![]() K+ I¯ I¯ K+
K+ I¯ I¯ K+

|
K+ I¯ I¯ K+
K+ K+ K+
K+ K+ K+ K+
K+ K+ K+
![]() Агрегат
Агрегат
 Ядро
Ядро
Коллоидная
 частица
частица
Мицелла
КОАГУЛЯЦИЯ – процесс укрупнения коллоидных частиц за счет слипания под влиянием молекулярных сил притяжения.
Этому процессу препятствует наличие у коллоидных частиц одноименного заряда. Чтобы вызвать коагуляцию золя, необходимо нейтрализовать заряд коллоидной частицы, тогда частицы будут сталкиваться и слипаться. Коагуляцию золя можно вызвать различными способами, легче всего при помощи электролитов.
При коагуляции золей электролитами происходит сжатие диффузного слоя, что позволяет коллоидным частицам подходить друг к другу на расстояние, на котором уже действуют силы межмолекулярного притяжения.
Различают 2 стадии коагуляции: скрытую и явную. При явно коагуляции изменяется окраска золя за счет укрупнения частиц, появляется муть, а дальше происходит седиментация – свободное оседание агрегатов коллоидных частиц под действием силы тяжести.
Для наступления явной коагуляции концентрация электролита должна быть равна или больше порога коагуляции золя.
Коагулирующая способность электролитов характеризуетсяПОРОГОМ КОАГУЛЯЦИИ (γс), т.е. минимальной концентрацией электролита в миллимолях на 1 л золя, при которой начинается явная коагуляция. Обратная величина порога коагуляции называетсяКОАГУЛИРУЮЩИМ ДЕЙСТВИЕМ (1/γс).
Коагулирующим действием обладает только тот ион электролита, который имеет заряд, противоположный заряду коллоидной частицы.
Например, на положительно заряженный золь железа гидроксида коагулирующее действие оказывают анионы, а на отрицательно заряженный золь Fe4[Fe(CN)6]3 (берлинской лазури) – катионы.
Коагулирующая способность иона тем больше, чем выше его валентность.
ПРАВИЛО ШУЛЬЦЕ-ГАРДИ (правило значности) гласит: из 2-х ионов электролита коагулирующим действием обладает тот, знак которого противоположен знаку заряда коллоидных частиц, причем это действие тем сильнее, чем выше валентность коагулирующего иона.
Зависимость между порогом коагуляции (γс) и валентностью (Z) коагулирующего иона выражается уравнением:
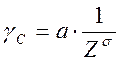
где γс – порог коагуляции
Z – валентность
а – коэффициент пропорциональности.
По теории Дерягина, порог коагуляции изменяется обратно пропорционально валентности коагулирующего иона в шестой степени:
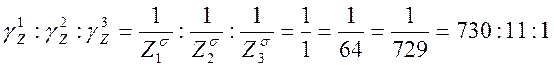
УЧЕБНО-ИССЛЕДОВАТЕЛЬСКАЯ РАБОТА N 16
Получение коллоидных растворов гидроксида железа (III)
и берлинской лазури
1. Получение золя Fe(OH)3 реакцией гидролиза
В конической колбе (250 мл) на электроплитке нагревают до кипения 150 мл дистиллированной воды (мерным цилиндром). Не снимая колбы, плитку выключают и небольшой струей вливают в воду пипеткой 5 мл концентрированного раствора железа (III) хлорида. Происходит гидролиз FeCl3, в результате чего образуется коллоидный раствор железа (III) гидроксида интенсивного красно-коричневого цвета, стабилизированный FeCl3.
Полученный золь охлаждают под краном до комнатной температуры. Если необходимо, то фильтруют через складчатый фильтр. Золь должен быть прозрачным в проходящем свете!
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.