135. Капля ртуті, яку одержали від злиття двох капель однакового радіуса нагріється на Dt=1.65×10-4 град. Який радіус у капель?
136.
В закритій посуді об'ємом ![]() м3
знаходиться 0,6к вуглекислого газу при деякому тиску
м3
знаходиться 0,6к вуглекислого газу при деякому тиску ![]() . При збільшені температури у 1,85 раз,
тиск збільшився удвоє. Користуючись рівнянням Ван-дер-Ваальса знайти тиск
. При збільшені температури у 1,85 раз,
тиск збільшився удвоє. Користуючись рівнянням Ван-дер-Ваальса знайти тиск ![]() газу.
газу.
137.
Азот (![]() моль) адіабатно
розширюється у вакуумі. Температура газу при цьому зменшується на 1 К. Знайти
роботу, що виконується проти міжмолекулярних сил тяжіння.
моль) адіабатно
розширюється у вакуумі. Температура газу при цьому зменшується на 1 К. Знайти
роботу, що виконується проти міжмолекулярних сил тяжіння.
138.
Кисень (![]() моль, реальний газ)
займає при
моль, реальний газ)
займає при ![]() К, об'єм
К, об'єм ![]() л,
потім розширюється ізотермічно до
л,
потім розширюється ізотермічно до ![]() . Знайти роботу при
розширенні та зміну внутрішньої енергії газу. Поправки a та b
прийняти рівними відповідно 0,136 Н×м4/моль2 та
. Знайти роботу при
розширенні та зміну внутрішньої енергії газу. Поправки a та b
прийняти рівними відповідно 0,136 Н×м4/моль2 та ![]() м3/моль.
м3/моль.
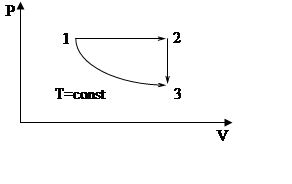
139.
1 моль водню із стану 1 перейде в стан 3 спочатку
по шляху 1-3, а потім по шляху 1-2-3. Довести на чисельному прикладі, що
ентропія – функція стану. ![]() м3;
м3; ![]() м3;
м3; ![]() ;
; ![]() К.
К.
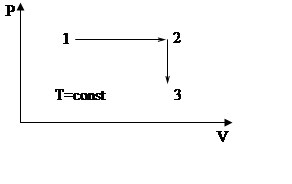
140.
1 моль водню із стану 1 переходить в стан 3 по
шляху 1-2-3. Знайти зміну ентропії. ![]() м3;
м3; ![]() м3;
м3; ![]() К;
К; ![]() К.
К.
141. Вуглекислий газ масою 88 г займає при температурі 290 К об'єм 1000 см3. Знайти нутрішню енергію газу, якщо: 1) газ ідеальний; 2) газ реальний. Поправку a прийняти рівною 0,361 Н×м4/моль2.
142.
Кисень (![]() моль) займає об'єм
моль) займає об'єм ![]() л. Знайти зміну температури кисню, якщо
він адіабатно розширюється у вакуумі до об'єма
л. Знайти зміну температури кисню, якщо
він адіабатно розширюється у вакуумі до об'єма ![]() л.
Поправку a прийняти рівною 0,136 Н×м4/моль2.
л.
Поправку a прийняти рівною 0,136 Н×м4/моль2.
143.
Кисень (![]() ) знаходиться у посудині
об'ємом
) знаходиться у посудині
об'ємом ![]() л. Знайти: 1) внутрішній тиск газу;
2) власний об'єм молекул. Поправки a та b прийняти рівними
відповідно 0,136 Н×м4/моль2 та
л. Знайти: 1) внутрішній тиск газу;
2) власний об'єм молекул. Поправки a та b прийняти рівними
відповідно 0,136 Н×м4/моль2 та ![]() м3/моль.
м3/моль.
144. Вуглекислий газ масою 6,6 кг при тиску 0,1 МПа займає об’эм 3,75 м3. Знайти температуру газу, якщо:1) газ реальний 2) газ ідеальний. Поправки а та b прийняти рівними відповідно 0,361 Н×м4/моль2 та 4,28×10-5 м3/моль.
145. Вуглекислий газ масою 2.2 кг знаходиться при температурі 290°К в посудині місткістю 30 л. Знайти тиск газу, якщо: 1) газ реальний 2) газ ідеальний. Поправки a та b прийняти рівними відповідно 6,361 Н×м3/моль та 4,28×10-5 м3/моль.
146. Густина азоту r=140 кг/м3, його тиск p=10 Мпа. Найти температуру газу, якщо: 1) газ реальний; 2) газ ідеальний. Поправки а та b прийняти рівними відповідно 0,135 Н×м3/моль та 3,86×10-5 м3/моль.
147. 0,5 кмоля деякого газу займає об’єм V1=1 м3. Після розширення газу до об’єму V2=1.2 м3 була виконана робота проти сил взаємодії молекул Aвз=580 Н/м. Найти для цього газу постійну а, яка входить в рівняння Ван-дер-Ваальса.
148. Найти тиск, зумовлений силами взаємодії молекул, що містяться у одному кіломолі газу, який знаходився при нормальних умовах. Критична температура та критичний тиск цього газу рівні відповідно Tк=417°К, Рк=76 атм.
149. У закритій посудині об’ємом V=0.5 м3 знаходиться 0.6 кмоля вуглекислого газу при тиску 3×106 Н/м2. Користуючись рівнянням Ван-дер-Ваальса, найти, у скільки разів требі змішати температуру газу, щоб тиск збільшився удвоє.
150. Для водню сили взаємодії між молекулами незначні; головну роль відіграють власні розміри молекул . 1) написати рівняння стану такого напівідеального газу. 2) Найти , яку помилку ми одержуємо при знаходженні числа кілограмів водню, який знаходився в деякому об’эмі при температурі t=0°С та тиску p=2.8×107 кг/м2, не враховуючи власних розмірів молекул.
Тема: “Другий початок термодинаміки”.
Індивідуальне завдання № 6
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.