![]() каждый из энергетических уровней, кроме S термов,
расщеплен на два за счет спин-орбитального взаимодействия. Значение J
равно J = L ± 1/2 при L
каждый из энергетических уровней, кроме S термов,
расщеплен на два за счет спин-орбитального взаимодействия. Значение J
равно J = L ± 1/2 при L ![]() 0 и J = 1/2 при L = 0.
Правила отбора аналогичны приведенным выше.
0 и J = 1/2 при L = 0.
Правила отбора аналогичны приведенным выше.
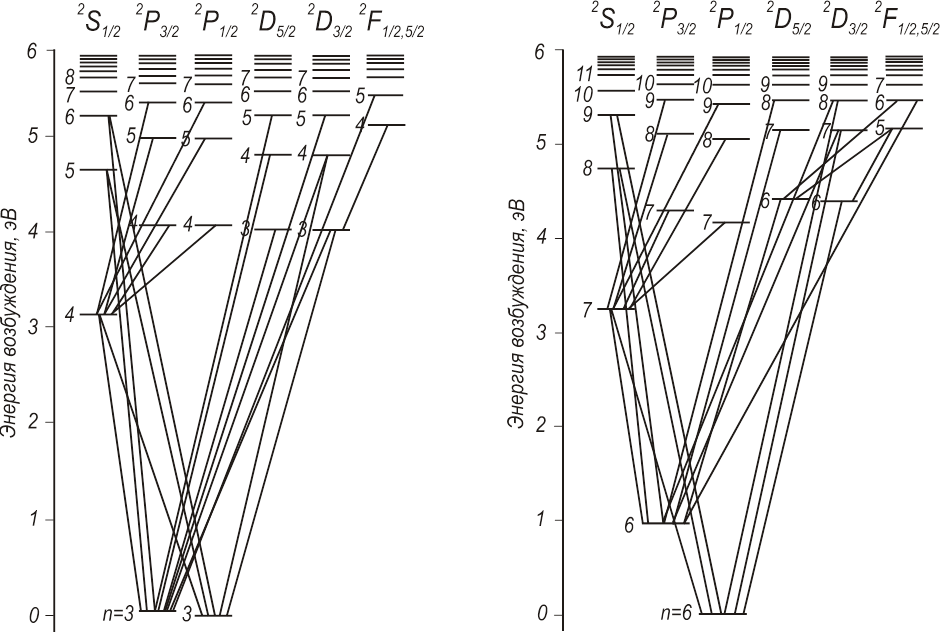
Каждая линия расщеплена на две:
![]()
![]() < nj = 2,3,4...
< nj = 2,3,4...
![]()
![]()
Одна из побочных серий:
22P3/2
> nj2S1/2 , nj = 3,4,5...
22 P1/2
![]()
Вторая побочная (диффузная) серия состоит из 3 линий:
22P1/2
> nj2D1/2
22P3/2 nj = 3,4,5...
22P3/2 ______ nj2D3/2
![]()
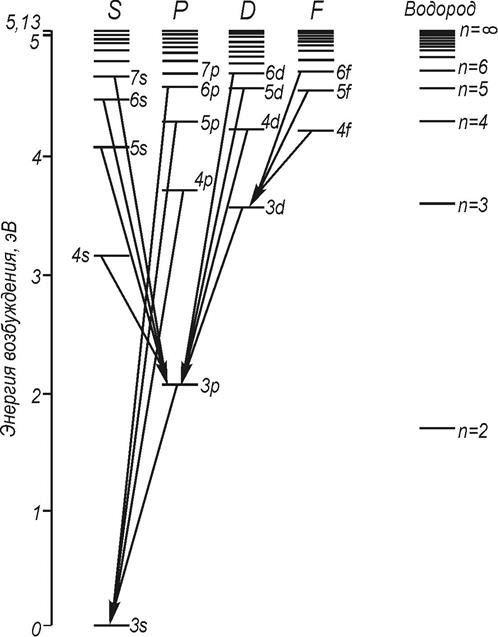
Спектры атомов с двумя и более электронами на S и P верхних подоболочках
(Фриш, 238, 245,248)
![]() Диаграмма Гротриана для атома гелия (1s2 )
Диаграмма Гротриана для атома гелия (1s2 )
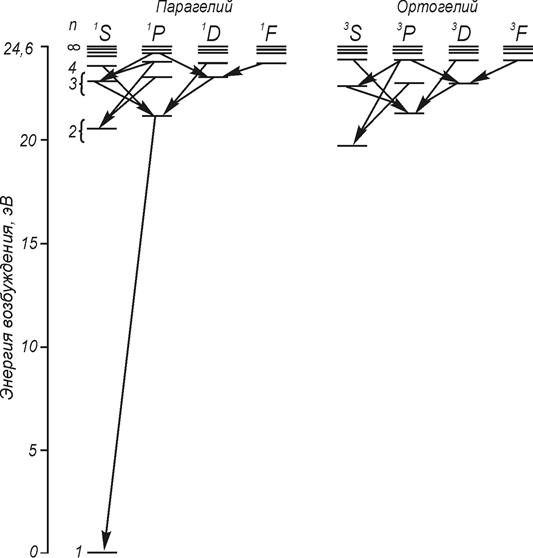

Оценка из диаграммы (n=2) для 2А~0.75 эВ.
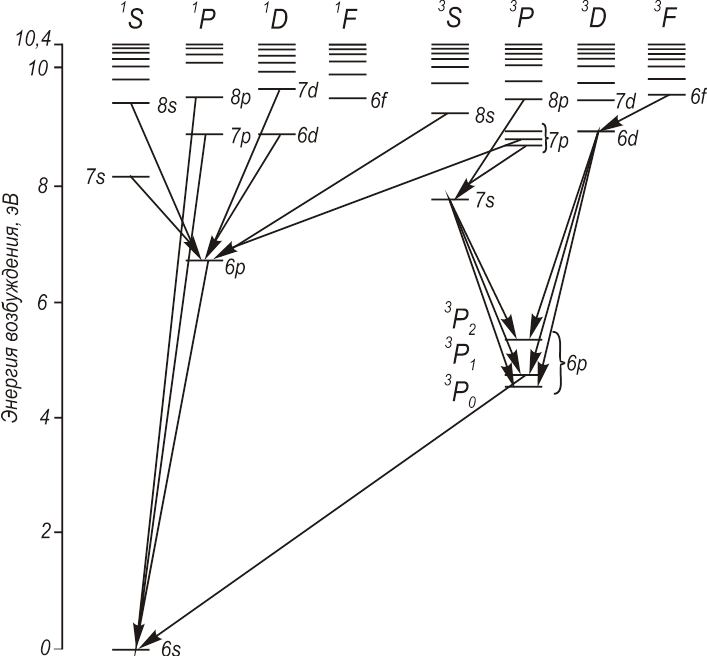
Ртуть (Z=72, ….. 5s25p65d106s2)
![]() Один р
электрон вне замкнутой подоболочки в атомах
: B, Al, Ga, In, Tl.
Один р
электрон вне замкнутой подоболочки в атомах
: B, Al, Ga, In, Tl.
B 1s22s22p1 Основной терм: 2P1/2
Al1s22s22p63s23p1 Основной терм: 2P1/2
Термы В при возбуждении р-электрона:
|
Электронные конфигурации |
Термы |
|||||
|
2s |
2p |
3s |
3p |
3d |
4f |
|
|
2 2 2 2 2 1 |
1 2 |
1 |
1 |
1 |
1 |
2P1/2,3/2 2S1/2 2P1/2,3/2 2D3/2,5/2 2F5/2,7/2 2S1/2 2P1/2,3/2 4P1/2,3/2,5/2 2D3/2,5/2 |
Алюминий (z=13) и таллий (z=81)
![]() Элементы с двумя р-электронами: C, Si, Sn, Pb.
Элементы с двумя р-электронами: C, Si, Sn, Pb.
C : 1s22s22p2 Основной терм: 3P0
Возможные термы C :
|
Электронные конфигурации |
Термы |
||||||
|
2s |
2p |
3s |
3p |
3d |
4f |
||
|
2 2 2 2 2 |
2 2 1 1 1 |
1 |
1 |
1 |
1 |
3P0,1,2 3P 0,1,2 3S1 3P0,1,2 3D1,2,3 3P0,1,2 3D1,2,3 3F2,3,4 3D1,2,3 3F2,3,4 3G3,4,5 |
1S0 1P1 1S0 1P1 1D2 1S0 1D2 1F3 1D2 1F3 1G4 |
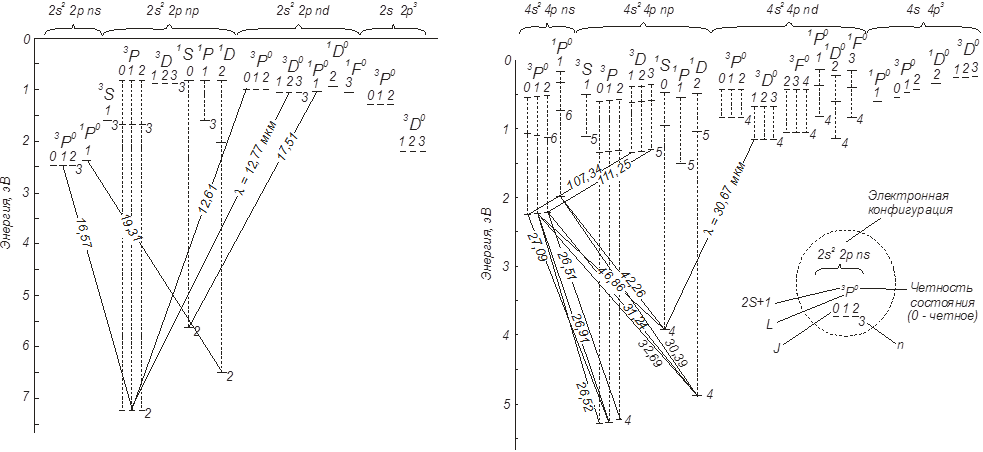 Углерод
(z=6) и германий (z=32)
Углерод
(z=6) и германий (z=32)
![]() Элементы с тремя эквивалентными р -
электронами: N, P, As, Sb, Bi.
Элементы с тремя эквивалентными р -
электронами: N, P, As, Sb, Bi.
N: 1s22s22p3 Основной терм: 4S3/2
Возможные термы N :
|
Электронные конфигурации |
Термы |
|||
|
2p |
2S |
3p |
3d |
|
|
3 2 2 2 |
1 |
1 |
1 |
2P 2D 4S 2P 4P 2D 2S 2S 2P 2D 2F 4S 4D 2P 2D 2F 2G 4P 4D 4F |
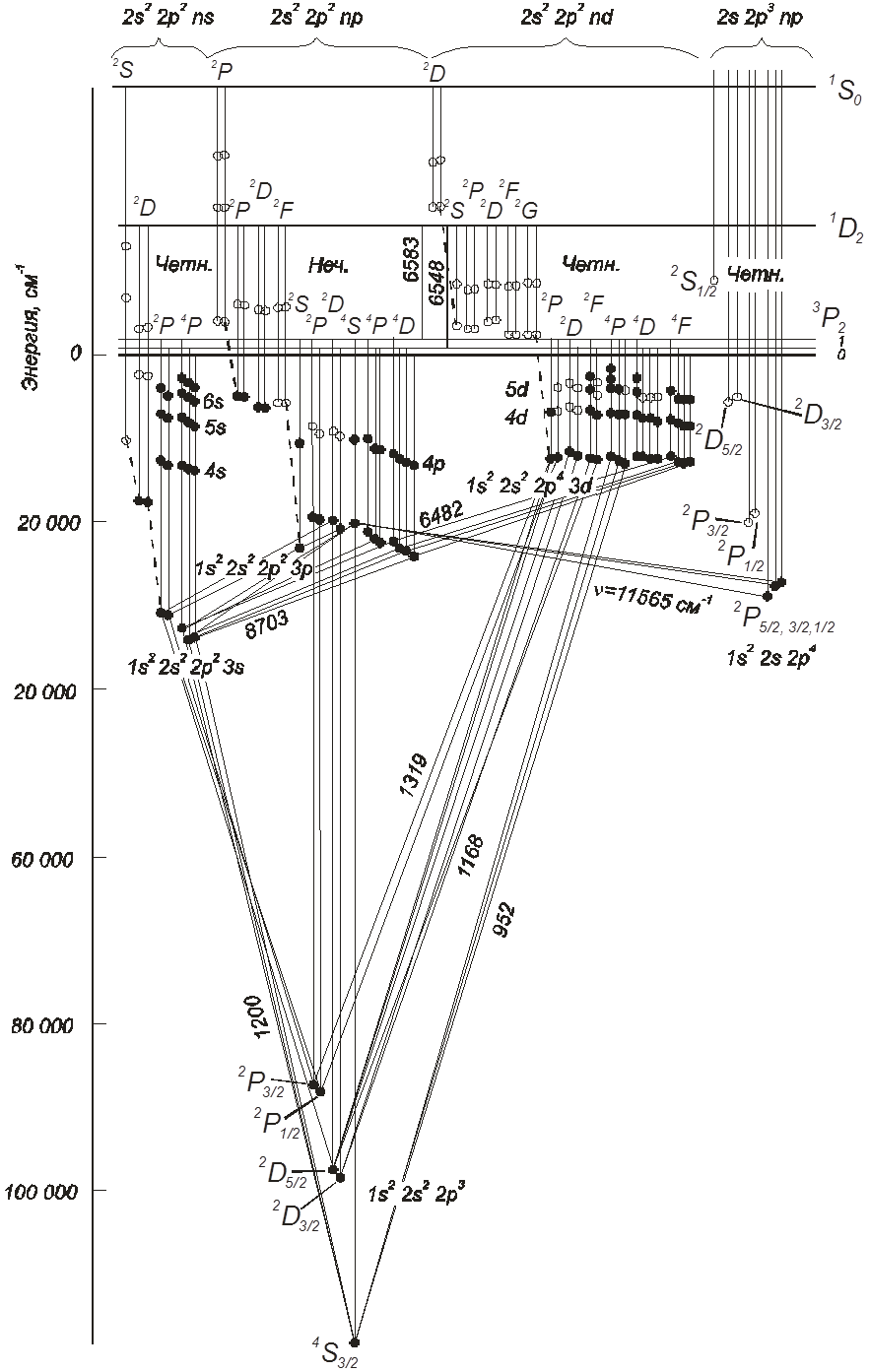
Азот N: 1s22s22p3
![]()
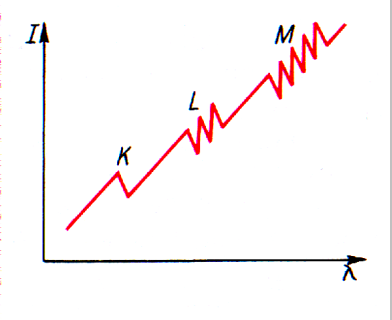
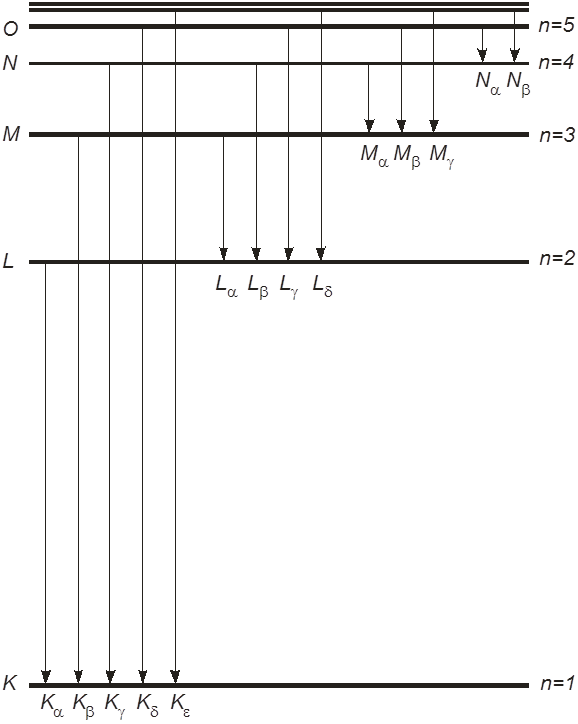
Спектры рентгеновского излучения
Энергия электрона на
внутренней оболочке: 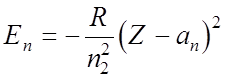
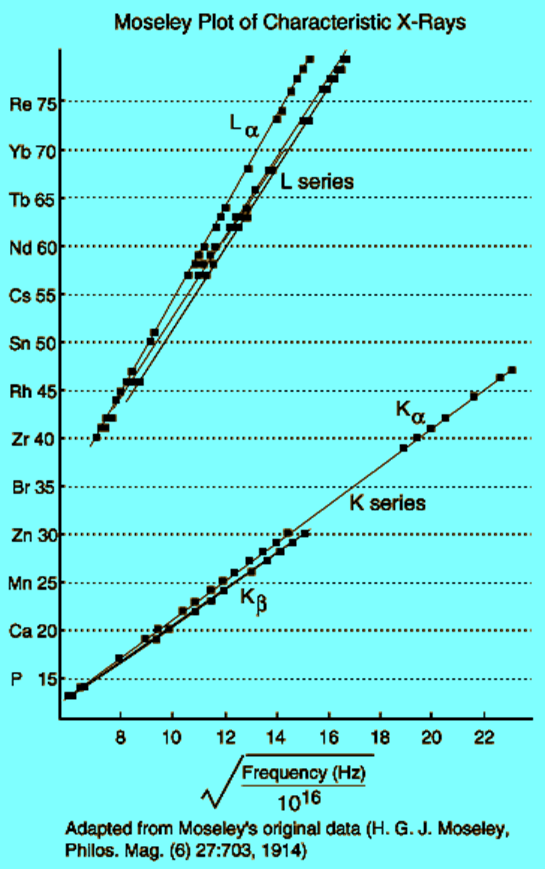
Для внутренних оболочек тяжелых элементов работает закон Мозли:
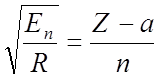
3 x 1016 Hz; 10-3 – 10 nm: 124 eV до 1Mev
Натрий: потенциалы ионизации 3s - 5,15эВ; 2р - 31 эВ;
2s - 63 эВ; 1s - 1041 эВ.
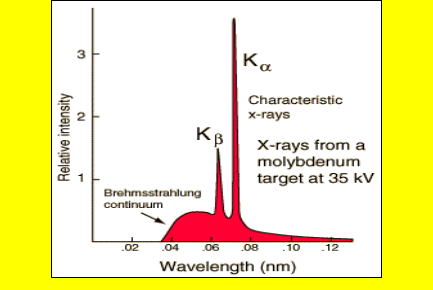
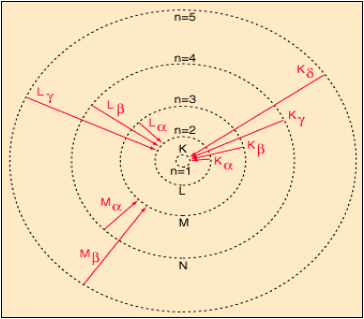
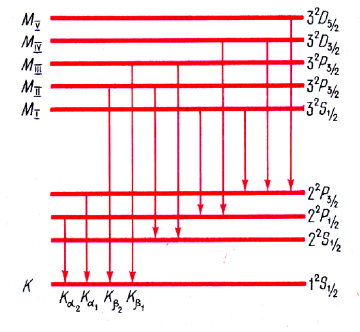
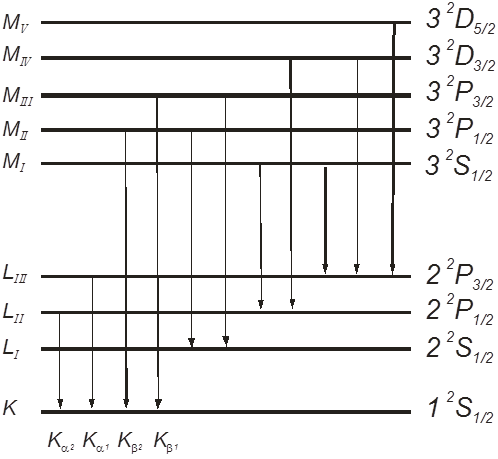
Характеристическое излучение Мо (Z= 42); Схема рентгеновских переходов
![]() Энергия
Энергия 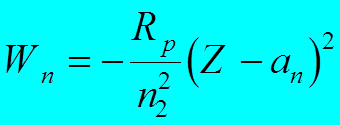
![]()
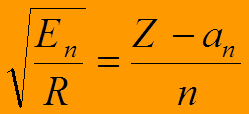 закон Мозли
закон Мозли
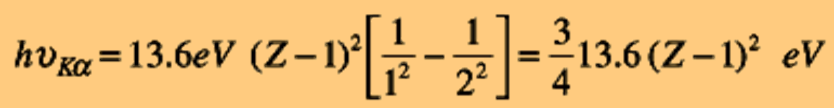
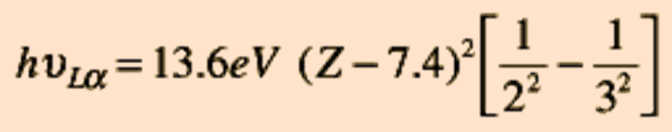
термов замкнутой оболочки без одного электрона эквивалентны термам с одним электроном.
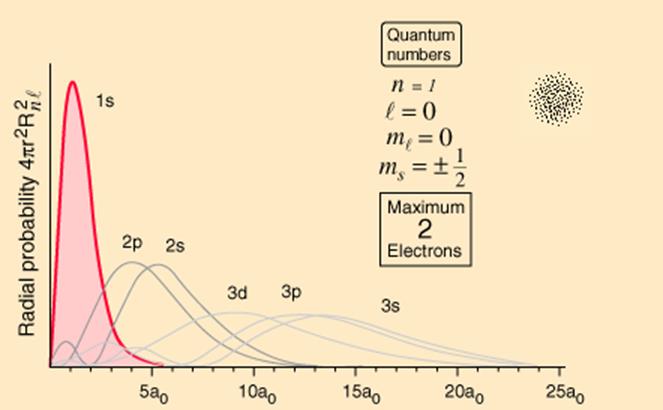
В К
оболочке имеем два электрона с квантовыми числами n = 1, ![]() = 0,
s = 1/2, j = 1/2 у каждого. Если один
электрон убрать, то оставшаяся оболочка (один электрон) имеет L = 0,
S = 1/2, J = 1/2, т.е. состояние 2S1/2
(один уровень энергии).
= 0,
s = 1/2, j = 1/2 у каждого. Если один
электрон убрать, то оставшаяся оболочка (один электрон) имеет L = 0,
S = 1/2, J = 1/2, т.е. состояние 2S1/2
(один уровень энергии).
Правила отбора DL = ±1, DJ = 0,±1
Электронная
конфигурация L - оболочки 2s22p6.
В этой оболочке в р состоянии находятся два электрона с j = 1/2
и четыре электрона с j = 3/2. Действительно, полный момент
всех электронов в подоболочке Р равен нулю. Полный момент j каждого
электрона может быть сосчитан методом определения всех значений проекций mj = ![]() + ms
. Величины проекций орбитального
+ ms
. Величины проекций орбитального ![]() и спинового моментов имеют значения
и спинового моментов имеют значения ![]() = +1,0,-1 и ms = ±1/2 для
каждого
= +1,0,-1 и ms = ±1/2 для
каждого ![]() .
Тогда, возможные значения mj равны:
.
Тогда, возможные значения mj равны:
mj = 3/2 = (1 + 1/2)
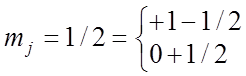 ;
; 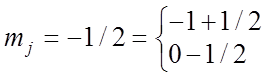 ;
;
![]() .
.
Максимальные
значения проекции ![]() Следовательно, максимальный полный момент равен j = 3/2
и его должны иметь четыре электрона, отличаясь проекциями (ms = ±3/2, ±1/2). Оставшиеся два электрона p подоболочки
имеют проекции mj = ±1/2, которые
соответствуют полному моменту j = 1/2.
Следовательно, максимальный полный момент равен j = 3/2
и его должны иметь четыре электрона, отличаясь проекциями (ms = ±3/2, ±1/2). Оставшиеся два электрона p подоболочки
имеют проекции mj = ±1/2, которые
соответствуют полному моменту j = 1/2.
В заключение отметим, что атом, у которого отсутствует внутренний электрон, может также потерять энергию возбуждения в результате эффекта Оже, не испуская рентгеновского фотона, а передавая ее другому электрону из внешних оболочек. Это приводит к дополнительной ионизации атома, а всю энергию уносит вылетевший электрон.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.