


НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ФАКУЛЬТЕТ ЕСТЕСТВЕННЫХ НАУК
КАФЕДРА ФИЗИЧЕСКОЙ ХИМИИ
Лабораторная работа Х-1
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ РАВНОВЕСИЯ РЕАКЦИИ ДЕГИДРИРОВАНИЯ ИЗОПРОПАНОЛА
Студент:
Быков Максим Михайлович
Преподаватель:
д. х.н. Талзи Евгений Павлович
НОВОСИБИРСК 2007 г.
Цель работы: определение константы равновесия Kp при разных температурах в указанном диапазоне; оценка ΔrHº реакции; расчет Kp по справочным данным.
Общие сведения
В данном методе используется один из наиболее эффективных методов анализа – газовая хроматография, которая также находит широкое применение в различных областях химической науки.
В газохроматографическом методе проявляются малейшие различия в физико-химических свойствах компонентов системы благодаря многократному повторению процессов распределения вещества между неподвижной фазой (сорбент) и подвижной фазой (газ-носитель).
Для непрерывного измерения концентрации разделяемых веществ в газе – носителе в комплекс газового хроматографа входит несколько различных детекторов, в нашем случае – детектор по теплопроводности. Катарометры наиболее широко используются в газовой хроматографии. В полость металлического блока помещена спираль из металла с высоким термическим сопротивлением. Через спираль проходит постоянный ток, в результате чего она нагревается. Если спираль обмывает чистый газ – носитель, спираль теряет постоянное количество теплоты и ее температура постоянна. Если газ – носитель содержит примеси, то меняется теплопроводность газа и, соответственно, температура спирали. Это приводит к изменению сопротивления нити, измеряя которое можем судить о количестве примесей в газе – носителе.
Схема экспериментальной установки
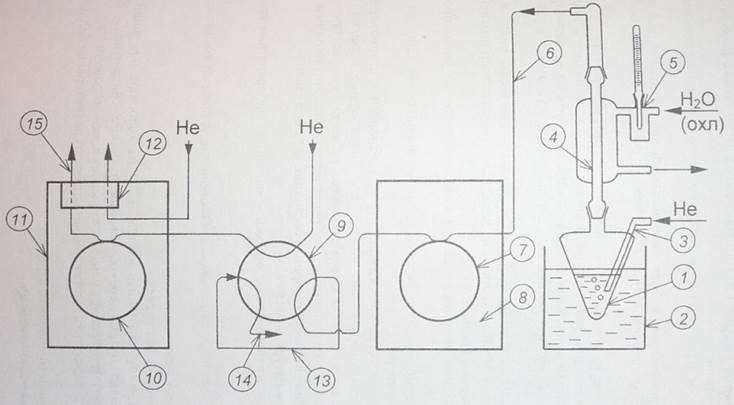
Колбочка с изопропанолом (1) погружена в водяную баню термостата (2). Поток гелия из баллона через редуктор и регулирующий вентиль подается через капилляр (3) в колбочку и пробулькивается через i-PrOH. Пары спирта в токе He попадают в обратный холодильник (4), охлаждаемый водой (5) с известной температурой (Тхол). Далее пары спирта по капилляру (6) попадают в реактор (7), который находится в хроматографе (8), использующемся как термостат для реактора. После реактора смесь газов попадает на кран – дозатор (9), проходит через дозирующую петлю (13) и сбрасывается в атмосферу через отросток (14), расположенный на передней панели хроматографа (11). Кран – дозатор служит для ввода пробы продуктов реакции в колонку (10). При повороте крана в положение «анализ» содержимое дозирующей петли (13) вводится в хроматограф, проходит колонку (10), детектор по теплопроводности (12) и сбрасывается в атмосферу через отросток (15), расположенный на верхней крышке хроматографа.
Теоретические основы метода
В данной работе мы определяли константу равновесия реакции дегидрирования изопропанола на медно-хромовом катализаторе:
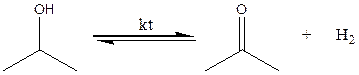
Теоретический расчет константы равновесия:
Константа
равновесия рассчитывается по формуле: 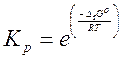
|
Вещество |
ΔrHº298 (кДж/моль) |
ΔrSº298 (Дж/мольּК) |
Cp = a + bּT +c/T2 |
||
|
a |
bּ103 |
cּ10-5 |
|||
|
H2 |
0 |
130.52 |
27.28 |
3.26 |
0.50 |
|
Cp = a + bּT +cּT2 |
|||||
|
a |
b ּ103 |
cּ106 |
|||
|
Ацетон |
-217.57 |
294.93 |
22.47 |
201.8 |
-63.5 |
|
Изопропанол |
-272.59 |
309.91 |
8.67 |
303.1 |
-115.8 |
|
T (K) |
Рассчитанное значение Кp |
|
393 |
0.053 |
|
413 |
0.12 |
Формула расчета константы равновесия из экспериментальных данных:
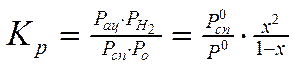
Здесь х – степень
превращения, ![]() , Pац
и Рсп – давление паров ацетона и спирта в смеси
продуктов реакции,
, Pац
и Рсп – давление паров ацетона и спирта в смеси
продуктов реакции, ![]() -
давление паров спирта в исходной реакционной смеси, P0
– давление, соответствующее стандартному состоянию (1 бар).
-
давление паров спирта в исходной реакционной смеси, P0
– давление, соответствующее стандартному состоянию (1 бар).
Если система не достигла равновесия, то величина, вычисленная по приведенной формуле – не есть константа реакции. В этом случае она называется произведением реакции, однако, при увеличении времени контакта газовой смеси с катализатором произведение реакции стремится к константе равновесия.
Ход работы
Определение константы равновесия реакции производилось следующим образом: газ – носитель (гелий) пропускался через колбу с нагретым изопропанолом, унося его пары в камеру с катализатором, в которой поддерживалась определенная температура. Путем изменения скорости газа-носителя, контролировалось время контакта изопропанола с катализатором и, соответственно, глубина протекания реакции.
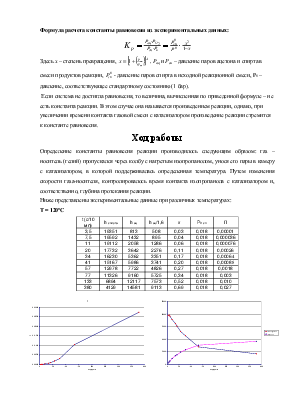
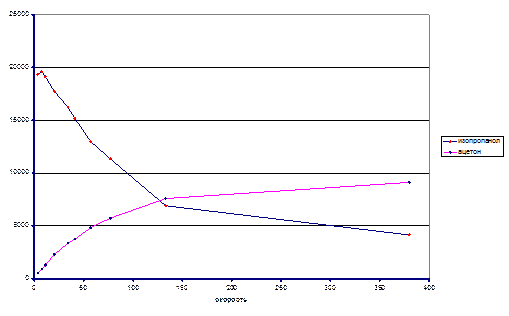
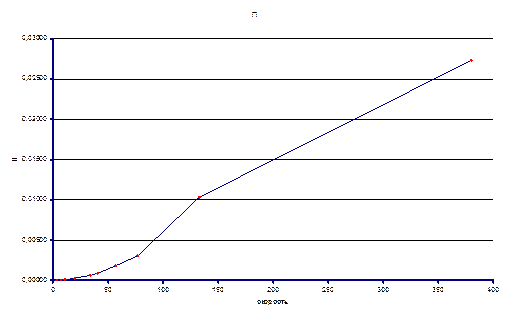
Ниже представлены экспериментальные данные при различных температурах:
T = 120ºC
|
t (c/10 мл) |
h спирта |
h ац |
h ац/1,6 |
x |
P0 сп |
П |
|
3,5 |
19351 |
813 |
508 |
0,03 |
0,018 |
0,00001 |
|
7,5 |
19592 |
1432 |
895 |
0,04 |
0,018 |
0,000036 |
|
11 |
19112 |
2058 |
1286 |
0,06 |
0,018 |
0,000076 |
|
20 |
17732 |
3642 |
2276 |
0,11 |
0,018 |
0,00026 |
|
34 |
16230 |
5362 |
3351 |
0,17 |
0,018 |
0,00064 |
|
41 |
15167 |
5986 |
3741 |
0,20 |
0,018 |
0,00088 |
|
57 |
12978 |
7722 |
4826 |
0,27 |
0,018 |
0,0018 |
|
77 |
11326 |
9160 |
5725 |
0,34 |
0,018 |
0,003 |
|
133 |
6894 |
12117 |
7573 |
0,52 |
0,018 |
0,010 |
|
380 |
4129 |
14581 |
9113 |
0,69 |
0,018 |
0,027 |
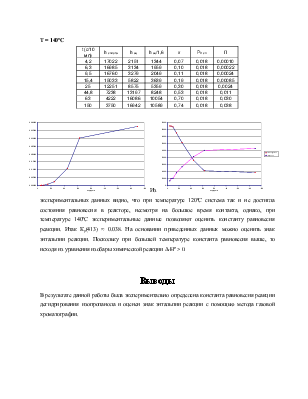
T = 140ºC
|
t (c/10 мл) |
h спирта |
h ац |
h ац/1,6 |
x |
P0 сп |
П |
|
4,2 |
17022 |
2151 |
1344 |
0,07 |
0,018 |
0,00010 |
|
6,3 |
16985 |
3134 |
1959 |
0,10 |
0,018 |
0,00022 |
|
9,5 |
16760 |
3279 |
2049 |
0,11 |
0,018 |
0,00024 |
|
15,4 |
15033 |
5822 |
3639 |
0,19 |
0,018 |
0,00085 |
|
25 |
12251 |
8575 |
5359 |
0,30 |
0,018 |
0,0024 |
|
44,8 |
7238 |
13197 |
8248 |
0,53 |
0,018 |
0,011 |
|
63 |
4222 |
16086 |
10054 |
0,70 |
0,018 |
0,030 |
|
150 |
3750 |
16942 |
10589 |
0,74 |
0,018 |
0,038 |
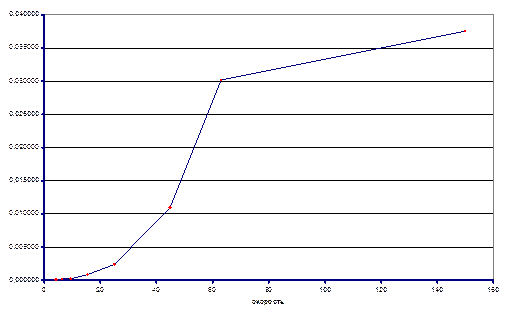
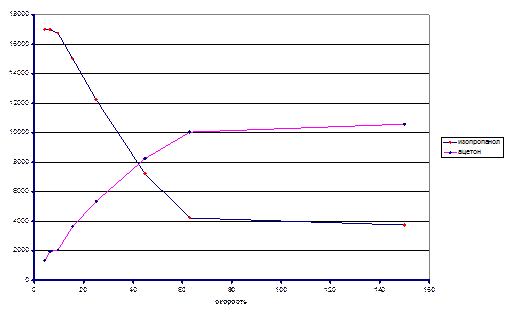
Из экспериментальных данных видно, что при температуре 120ºС система так и не достигла состояния равновесия в реакторе, несмотря на большое время контакта, однако, при температуре 140ºС экспериментальные данные позволяют оценить константу равновесия реакции. Итак Кp(413) ≈ 0.038. На основании приведенных данных можно оценить знак энтальпии реакции. Поскольку при большей температуре константа равновесия выше, то исходя из уравнения изобары химической реакции ΔrHº > 0.
Выводы
В результате данной работы была экспериментально определена константа равновесия реакции дегидрирования изопропанола и оценен знак энтальпии реакции с помощью метода газовой хроматографии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.