



Новосибирский государственный университет
Факультет Естественных наук
Кафедра физической химии
Лабораторная работа
На тему:
Определение константы диссоциации 2,4-динитрофенола по спектроскопическим данным
Выполнили: Гущина Т. А.
Боровикова Е. И.
Проверила: Волкова О.С.
Новосибирск 2006
В данной работе исследуется кислотно-основное равновесие, устанавливающееся в растворе 2,4-динитрофенола (α-ДНФ). Схематично процесс диссоциации, протекающий в растворе ДНФ, можно представить следующим уравнением:
В случае достаточно разбавленных растворов константа диссоциации индикатора связана с его степенью диссоциации α и с pHрвствора соотношением
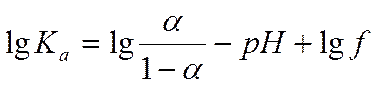
Значение степени диссоциации находится из измерений оптической плотности растворов ДНФ в буфере с известным значением рН по формуле
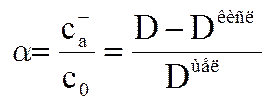
Для этогоже раствора по формуле Дебая-Хюккеля определяется коэффициент активности f-
![]()
где 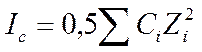
Для точности определения Ка необходимо выполнение следующих условий:
1. концентрация ДНФ в кислых, щелочных и буферных ратворах должна быть выбрана так, чтобы максимальные значения оптических плотностей всех растворов находились в пределах рабо
Поглощение света зависит от природы вещества и от длины волны:
Д=lg(Joλ/Jλ),
где Joλ – интенсивность падающего света, Jλ – интенсивность выходящего света.
Д=ελ*c *l
Где ελ– мольный коэффициент экстинкции, с – молярная концентрация,
l толщина раствора в кювете. ελ зависит от свойств молекулы, природы растворителя, длины волны и температуры, но как правило не зависит от концентрации.
Закон Бера:Поглощение света в тонком слое пропорционально концентрации поглощающих свет частиц:
εА-=Дщел./с0*l;
εАH=Дкисл./с0*l;
Где c0 – аналитическая концентрация вещества.
α=сA-/с0= Дкисл.-Д/ Дкисл.- Дщел..
Константа диссоциации кислоты НА равна константе равновесия реакция:
К=( сA-* сН+/ сAH)*( fA-* fН+/ fAH).
lg f+=-0,509*√I/(1+√I), где I=0,5∑сi* zi2
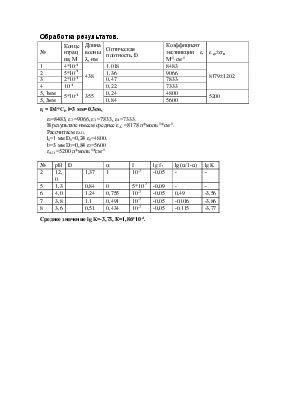
lg K=lg (α/1-α)-pH+lg f+.
Экспериментальная часть.
pH=4,3 V=200 мл, с(NaOAc)=0,01М Мr(NaOAc*3H2O)=136,08,
pH=4,0. m(NaOAc)=M*c*V=0,2722г
СН3СООН→СН3СОО-+Н+; Ka=[OAc-]*[H+]/[HOAc]=1,76*10-5, [H+]=10-4М.
[HOAc]=[OAc-]*[H+]/ Ka=0,05684 M. У нас же раствор 0,3 М, тогда необходимо его V0=0,05684*0,2/0,3=38 мл
буфер2 pH=3,8, буфер3 pH=3,6
№1 20 мл ДНФ+5 мл 0,1 М NaOH+25 мл H2O
№2 50 мл ДНФ+10 мл 0,1 М NaOH+40 мл H2O
№3 10 мл ДНФ+5 мл 0,1 М NaOH+35 мл H2O
№4 5 мл ДНФ+5 мл 0,1 М NaOH+40 мл H2O
№5 50 мл ДНФ+50 мл 0,1 М HCl
№6 20 мл ДНФ+25 мл буфер1
№7 20 мл ДНФ+25 мл буфер2
№8 20 мл ДНФ+25 мл буфер3
|
№ |
Концентрация, М |
Длина волны l, нм |
Оптическая плотность, D |
Коэффициент экстинкции e, М-1×см-1 |
e ср±sп |
|
1 |
4*10-4 |
438 |
1.018 |
8483 |
8179±1202 |
|
2 |
5*10-4 |
1,36 |
9066 |
||
|
3 |
2*10-4 |
0,47 |
7833 |
||
|
4 |
10-4 |
0,22 |
7333 |
||
|
5, 1мм |
5*10-4 |
355 |
0,24 |
4800 |
5200 |
|
5, 3мм |
0,84 |
5600 |
εi = D/l*Ci, l=3 мм=0.3см,
ε1=8483, ε2 =9066, ε3 =7833, ε4 =7333.
В результате имеем среднее εА- =8178 л*моль-1*см-1.
Рассчитаем εАН.
l1=1 мм D1=0,24 ε1=4800.
l2=3 мм D2=0,84 ε2=5600
εАН.=5200 л*моль-1*см-1
|
№ |
pH |
D |
a |
I |
lg f+ |
lg (α/1-α) |
lg K |
|
|
2 |
12,0 |
1,37 |
1 |
10-2 |
-0,05 |
- |
- |
|
|
5 |
1,3 |
0,84 |
0 |
5*10-2 |
-0,09 |
- |
- |
|
|
6 |
4,0 |
1.24 |
0,755 |
10-2 |
-0,05 |
0,49 |
-3,56 |
|
|
7 |
3,8 |
1.1 |
0,491 |
10-2 |
-0,05 |
-0.016 |
-3,86 |
|
|
8 |
3,6 |
0,51 |
0,434 |
10-2 |
-0,05 |
-0.115 |
-3,77 |
|
Среднее значение lg K=-3,73, К=1,86*10-4.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.