Цель работы: исследование структуры спектра поглощения молекулы йода, установление закономерностей электронно-колебательно-вращательных переходов в двухатомной молекуле, определение спектроскопическим методом энергии диссоциации, величины колебательного кванта и постоянной ангармоничности колебаний для молекулы I2 в основном и электронно-возбужденном состояниях.
Краткая теория
Молекулярные спектры поглощения и излучения содержат колебательную и вращательную структуру молекул веществ.
Химическое и пространственное строение молекул объясняется квантовой механикой с помощью приближения Борна-Оппенгеймера:
![]() , где r,
R–
электронные и ядерные координаты.
, где r,
R–
электронные и ядерные координаты.
Полная энергия молекулы при этом равна сумме энергии электронов и энергии ядра.
Электронные термы находятся по измеренным уровням энергии En(R), где R – межъядерное расстояние. Если En(R) имеет минимум, то такое состояние связное, иначе распадное. Однако, существуют молекулы у которых в основном состоянии нет минимума, а в возбужденном он появляется, что говорит о возможности существования таких молекул только в возбужденном состоянии.
Колебательно-вращательная структура
При заданном
электронном состоянии движение ядер есть движение точечных частиц,
взаимодействующих между собой с потенциалом En(R).
Положение двух ядер задается шестью координатами, определяющими движение
молекулы как целого, вращение молекулы и радиальное движение ядер (колебания).
При этом уравнение Шредингера в системе центра масс имеет следующее
факторизованное по угловым и радиальным переменным решение: ![]() . Радиальное движение происходит в
потенциале
. Радиальное движение происходит в
потенциале 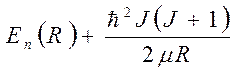 , где µ – приведенная масса ядра +
оболочки электронов.
, где µ – приведенная масса ядра +
оболочки электронов.
При малых J
вклад центробежного потенциала мал и R можно
заменить на Re(равновесное
межъядерное расстояние), при этом ![]() , где
, где 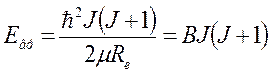 , B – вращательная постоянная.
, B – вращательная постоянная.
Колебательная
структура хорошо описывается потенциалом Морзе:![]() , где a – постоянная, а x= R
–Re, где D – глубина потенциальной ямы, определяющая энергию
диссоциации молекул (за вычетом нулевых колебаний). Разлагая потенциал Морзе
вблизи Re , получим равновесную частоту ангармонических
колебаний системы:
, где a – постоянная, а x= R
–Re, где D – глубина потенциальной ямы, определяющая энергию
диссоциации молекул (за вычетом нулевых колебаний). Разлагая потенциал Морзе
вблизи Re , получим равновесную частоту ангармонических
колебаний системы: 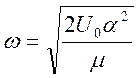 .
.
Уравнение Шредингера с потенциалом Морзе допускает
точного решения и энергетический спектр частицы представляется в виде: 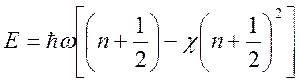 . Из условия экстремальности спектра Морзе
получим связь:
. Из условия экстремальности спектра Морзе
получим связь: ![]() .
. ![]() .
.
Правила отбора
Молекулы характеризуются набором квантовых чисел (N, J, n), где N – совокупность квантовых чисел, характеризующих состояние электронов.
Вращательный переход – (N, J", n) ↔ (N, J', n): ![]() , d(Re) ≠ 0.
, d(Re) ≠ 0.
Колебательно-вращательный
переход
– (N, J", n") ↔ (N, J', n'): ![]() ,
,![]() (гармонический
потенциал),
(гармонический
потенциал), ![]() (ангармонический потенциал),
(ангармонический потенциал), 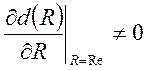 .
.
В гомоядерных молекулах в пределах одного электронного терма запрещены как вращательные, так и колебательно-вращательные переходы.
Электронно-колебательно-вращательные переходы – ΔS = ΔSz = 0, должен сохраняться знак Σ-состояния, для гомоядерных молекул разрешены только переходы между состояниями разной четности g ↔ u. Помимо условия ΔJ = ±1 возникает возможность перехода без изменения вращательного квантового числа ΔJ = 0, но только не между Σ-состояниями и не между состояниями с J = 0.
Принцип Франка-Кондона: электронный переход в молекуле совершается настолько быстро по сравнению с колебательным движением, что при этом ни межъядерное расстояние, ни скорости движения ядер практически не меняются.
Поэтому вероятность
перехода будет максимальной, если ядерные волновые функции начального и
конечного состояний локализованы в одной и той же области пространства. В итоге
матричный элемент перехода оказывается пропорционален интегралу перекрытия
ядерных волновых функций, описывающих начальное и конечное состояние ядерной подсистемы
и принадлежащих различным электронным термам молекулы: ![]() .
.
Квадрат интеграла перекрытия называется фактором Франка–Кондона F. Он определяет относительную вероятность заселения конкретного уровня n' при переходах (N”, J", n") → (N’, J', n'), или уровня n" при переходах (N', J', n') → (N", J", n").
Электронно-колебательно-вращательный спектр поглощения двухатомной молекулы
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.