Для моля вещества, состоящего из линейных молекул, поступательная и вращательная составляющие энтропии Sпост и Sвp равны:
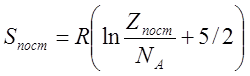
![]()
Колебательная составляющая энтропии, соответствующая i-му колебанию, равна:
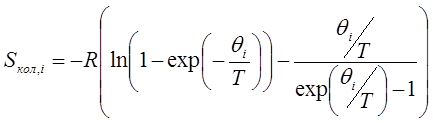 ,
,
где θi - характеристическая колебательная температура 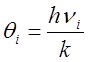 .
.
Полная вращательная энтропия определяется как сумма по всем колебаниям молекулы с учетом вырождения:
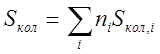 , где ni - вырождение i-ro колебания.
, где ni - вырождение i-ro колебания.
Внутренняя энергия.
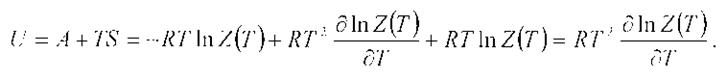
Эту формулу также можно применить к отдельным видам молекулярного движения:
Uпост = (3/2)RT.
При Т>>θвращ получаем:
Uвращ = RT (для линейных молекул) и
Uвращ = (3/2)RT (для нелинейных молекул).
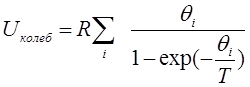 .
.
Выражения для Н и G:
Hпост = Uпост + pV = (5/2)RT,
Нвращ = Uвращ,
Нкол = Uкол,
Gпост = Апост + pV = Апост + RT,
Gвращ = Aвращ
Gкол = Aкол
Теплоемкость.
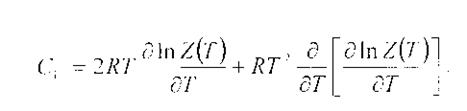
Спектры молекул, в отличие от линейных спектров атомов, состоят из широких полос, которые иногда распадаются на отдельные тесно расположенные лини. Вращательным спектрам поглощения соответствуют волновые числа 1-50 см-1 и меньше, т.е. эти спектры лежат в далекой ИК области и в области радиочастот. В колебательных спектрах молекул основные переходы расположены в области 100-4000 см-1, поскольку вместе с колебаниями возбуждаются и вращения молекул, фактически в этой спектральной области наблюдаются не чисто колебательные, колебательно-вращательные спектры.
Решение уравнения Шредингера дает следующее выражение для термов вращательной энергии жесткой двухатомной молекулы:
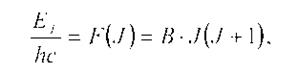
где В – вращательная постоянная, J – вращательное квантовое число, принимающее значение 0, 1,2...
Выражение для термов колебательной энергии двухатомной молекулы в приближении гармонического осциллятора имеет вид:
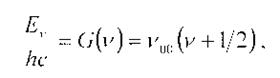
где ν00 - расстояние между соседними колебательными уровнями энергии (см-1), ν –колебательное квантовое число.
Термы колебательно-вращательных состояний являются суммой колебательной и вращательной составляющих:
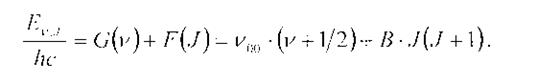
Рассмотрим вращательную структуру колебательно-вращательных ИК-спектров. В соответствии с правилом отбора ΔJ = ± 1 осуществляются 2 серии переходов между вращательными состояниями разных колебательных уровней. Поэтому в спектре, соответствующему одному колебательному переходу, наблюдается 2 серии линий, которые называют ветвями полосы: серия линий называется R-ветвью, если ΔJ = +1 и Р-ветвью, если ΔJ = -1. Между R- и Р-ветвями находится так называемый нулевой промежуток ν00, который соответствует чисто колебательному переходу, запрещенному по правилам отбора для большинства двухатомных молекул. Переход, при котором ΔJ = 0, – это Q-ветвь, которая может наблюдаться в спектрах молекул типа шарового волчка, линейных многоатомных молекул и двухатомных молекул, имеющих отличный от нуля спин в основном электронном состоянии.
Отсчет линий Р-ветви начинается с J = 1 (переход из ν” = 0, J” = 1 в ν’ = 1, J’ = 0), Линии R-ветви расположены со стороны больших волновых чисел от ν00, а первая наблюдаемая линия соответствует переходу из ν " = 0, J” = 0 в ν’ = 1, J’ = 1.
Волновые числа переходов, соответствующих R-ветви, для которой J = J + 1, равны:
νR = ν00 +F’(J’)-F”(J”) = ν00 + B’ ·(J + 1)(J +2) – B” ·(J + 1)J =
= ν00 + 2B0 + (3B’ - B”) J + (B’ - B”)J2
Как принято в спектроскопии, величины, отмеченные двумя штрихами, относятся к исходному состоянию, отмеченные одним штрихом – к конечному состоянию. Вращательные квантовые числа для R-ветви принимают значения 0, 1,2...
Волновые числа переходов, соответствующих Р-ветви, для которой J’ = J” - 1, равны:
νP = ν00 +F’(J’)-F”(J”) = ν00 + B’ (J - 1)J – B” (J + 1)J = ν00 – (B’ + B”) J + (B’ - B”)J2 ,
где В” и В’ – вращательные постоянные для состояний с ν = 0 и ν = 1, соответственно. Вращательные квантовые числа для Р-ветви принимают значения 1,2,3...
Поскольку разность (В’ – В” ) мала, то для малых J можно пренебречь взаимодействием колебаний с вращениями и принять В’ ~ В" ~ В. Тогда:
vR=v00 +2В + 2В·J, vR=v00 -2В·J
Таким образом, наблюдаемый спектр в первом приближении (жесткий ротатор) представляет собой серию равноотстоявших линий с расстояниями между ними, равными 2В.
Для нежесткого ротатора уровни вращательной энергии представляются в виде:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.