

ЦЕЛЬ РАБОТЫ: изучение свойств разбавленных растворов криоскопическим методом. Определение молекулярного веса растворенного вещества (неэлектролита) по экспериментально измеренной величине понижения температуры замерзания раствора.
Раствор – это гомогенная система, состоящая из двух или более веществ. Одно из веществ, обычно которого больше, условно называют растворителем, остальные – растворенными веществами. Раствор характеризуется концентрацией, то есть относительным количеством веществ в растворе. Чаще всего концентрация выражается молярностью и мольной (молярной) долей.
Молярность (обозначается буквой С) – число молей растворенного вещества на 1 литр раствора.
Молярность (m) – число молей растворенного вещества на 1000 г. растворителя.
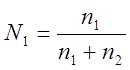
Мольная доля (N) – отношение
числа молей растворенного вещества к сумме молей растворителя и растворенных
веществ. Если раствор состоит из 2-х компонентов А и В (n1
– число молей вещества А и n2 - число молей вещества В), то мольные доли N1 и N2
соответственно равны:
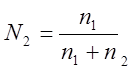 |
Сумма мольных долей компонентов, составляющих раствор, равна единице
N1 + N2 =1
Растворы по своим свойствам классифицируются на идеальные и реальные. Раствор называют идеальным, если при любом соотношении компонентов образование его не сопровождается изменением объема (расширением или сжатием), выделением или поглощением теплоты. Растворы, образованные веществами, сходными по химическому и по физическим свойствам, а также бесконечно разбавленные растворы, по своему поведению близки к идеальным. К таким растворам применимы следующие закономерности.
Понижение давления пара растворителя над раствором.
При равновесии между жидкостью и паром количество испаряющихся молекул за единицу времени равно числу конденсирующихся молекул. Если растворить в летучей жидкости небольшое количество какого-либо вещества, то концентрация молекул растворителя снизится и в соответствии с этим понизится и количество испаряющихся молекул, то есть давление насыщенного пара.
Для растворов давление насыщенных паров зависит не только от температуры, но и от концентрации. Опыт показывает, что давление пара растворителя над раствором нелетучего вещества всегда ниже, чем у чистого растворителя при той же температуре. Рауль установил, что давление пара растворителя над раствором Р1 пропорционально мольной доле N1 содержания его в растворе,
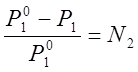 |
Это соотношение, установленное Раулем эмпирическим путем, показывает, что при постоянной температуре относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
Понижение температуры замерзания растворов.
Криоскопия.
В связи с понижением давления пара растворителя над раствором, растворы нелетучих веществ кристаллизуются (замерзают) при температурах более низких, чем чистый растворитель. Температурой замерзания жидкости называют температуру, при которой жидкость и образующееся из неё при кристаллизации твердое вещество находится в равновесии, то есть имеет одинаковое давление насыщенного пара,
Р1(ж) = Р1(кр)
m1(ж) = m1(кр)
где m1(ж) и m1(кр) – химические потенциалы растворителя в жидком и кристаллическом состояниях.
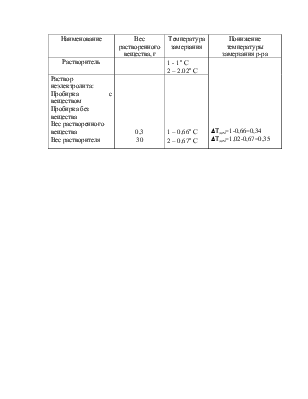
Наименование |
Вес растворенного вещества, г |
Температура замерзания |
Понижение температуры замерзания р-ра |
Растворитель |
1 - 1° С 2 – 2.02° С |
DТзам=1-0,66=0,34 DТзам=1,02-0,67=0,35 |
|
Раствор неэлектролита:Пробирка с веществом Пробирка без вещества Вес растворенного вещества Вес растворителя |
0,3 30 |
1 – 0,66° С 2 – 0,67° С |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.