Лабораторная работа № 6
ИЗУЧЕНИЕ МОЛЕКУЛЯРНОГО СПЕКТРА ПОГЛОЩЕНИЯ.
ОПРЕДЕЛЕНИЕ ЭНЕРГИИ ФОТОДИССОЦИАЦИИ МОЛЕКУЛЫ ЙОДА
Цель работы: ознакомиться с основными положениями молекулярной спектроскопии, со структурой молекулярного спектра поглощения; определить энергию фотодиссоциации молекулы йода I2.
Приборы и принадлежности: монохроматор УМ-2 с головкой; лампа накаливания в кожухе; неоновая лампа в кожухе; блок питания лампы накаливания; кювета с кристаллическим йодом, снабженная нагревателем и укрепленная на штативе; регулятор напряжения (РНШ); трансформатор для питания нагревателя кюветы; конденсор.
Теоретическая часть работы
Молекулярные спектры значительно сложнее атомных, так как в молекуле, наряду с движением электронов относительно ядер, происходят колебания ядер и вращение молекулы как единой системы. Приближенно полная энергия молекулы W может быть представлена в виде суммы электронной We, колебательной Wv и вращательной Wr энергий:
W = We + Wv + Wr . (6.1)
Электронная энергия молекул составляет 1–10 эВ, колебательная энергия молекул измеряется в десятых долях электрон-вольта, а вращательная – в тысячных долях электрон-вольта. Благодаря такому резкому различию в значениях энергии отдельных видов движения их можно рассматривать раздельно, приближенно полагая, что, например, движение электронов происходит независимо от колебаний ядер и вращения молекулы как целого. По той же причине вращательные спектры находятся в далекой инфракрасной и микроволновой областях, колебательные спектры располагаются в средней и ближней инфракрасной областях (1–40 мкм), а электронные спектры – в ультрафиолетовой, видимой и ближней инфракрасной областях (120–1000 нм).
В случае двухатомной молекулы имеем:
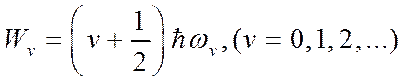 . (6.2)
. (6.2)
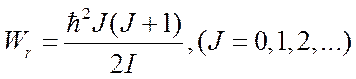 . (6.3)
. (6.3)
Здесь v и J – колебательное и вращательное квантовые числа, ωv – классическая частота осциллятора, I – момент инерции молекулы.
С учетом (6.2) и (6.3) выражение для полной энергии молекулы (6.1) примет вид:
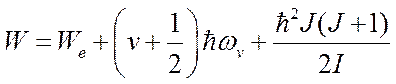 .
.
Схема энергетических уровней двухатомной молекулы приведена на рис. 6.1.
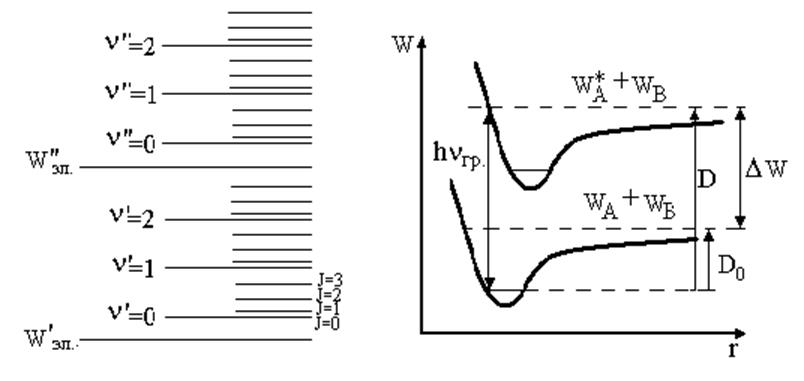
|
Рис. 6.1 |
Рис. 6.2. Энергии диссоциации: D0 –невозбужденные молекулы, D - возбужденные молекулы |
В зависимости от того, изменение каких видов энергии (колебательной, вращательной или электронной) обусловливает испускание (или поглощение) молекулой фотона, различают три вида полос испускания (или поглощения): вращательные, колебательные и электронно-колебательные.
Образование молекулы из атомов А и В сопровождается понижением потенциальной энергии взаимодействия атомов на величину, равную D0 (рис. 6.2). При этом соответствующая энергия выделяется или в виде тепла, или в виде излучения. Очевидно, что для разложения (диссоциации) молекулы на атомы в основном состоянии надо затратить столько же энергии, сколько выделилось при ее образовании из атомов, и тем больше, чем прочнее химическая связь между ними, чем устойчивее молекула.
Фотохимическая диссоциация – диссоциация под действием света. В результате фотохимической диссоциации один из образующихся атомов оказывается в возбужденном состоянии, неся в себе избыток энергии ΔΕ поглощенного кванта света hν.
Поглощение квантов света с энергией hν < hνгр (рис. 6.2) не приводит к фотодиссоциации, а в соответствующей области спектра возможно появление колебательно вращательной структуры. Для спектра поглощения в этом случае характерно схождение полос к границе диссоциации верхнего электронного уровня hνгр. (рис. 6.3).
Кванты света с hν > hνгр вызывают фотодиссоциацию, а спектр переходит в сплошной.
Значение hνгр может быть найдено по наблюдению электронно-колебательно-вращательного спектра поглощения молекул. Этот спектр состоит из полос, возникающих при переходе с нижнего колебательного уровня основного электронного состояния на ряд колебательных уровней первого возбужденного состояния (рис. 6.1).
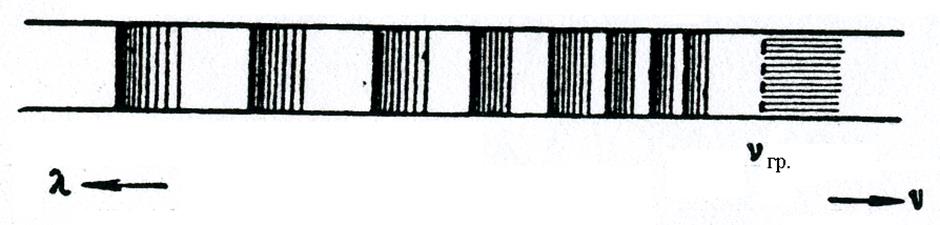
Рис. 6.3.
Полосы спектра поглощения молекул йода расположены в видимой области спектра, причем они имеют характерный вид: резкий кант со стороны больших длин волн и постепенный спад интенсивности при уменьшении длины волны.
За пределом сбегания полос лежит область сплошного поглощения. В этой области энергия поглощения фотона идет не только на диссоциацию молекул, но и на сообщение одному из атомов диссоциирующей молекулы кинетической энергии.
Как отмечалось выше, при диссоциации возбужденной молекулы один из образующихся атомов возбужден:
![]() (6.5)
(6.5)
Найдя предел сбегания полос (λгр и νгр), можно вычислить hνгр. Энергию фотодиссоциации молекулы D0 (рис. 6.2) можно найти, если вычесть из hνгр энергию ΔW возбуждения атома йода.
Практическая часть работы
1. Изучить устройство монохроматора УМ-2.
2. Ознакомиться со спектром излучения лампы накаливания.
3. Ознакомиться с градуировочным графиком, прилагаемым к монохроматору УМ-2.
4. Используя в качестве источника света неоновую лампу, проверить градуировку монохроматора.
5. Ознакомиться с молекулярным спектром поглощения и определить энергию фотодиссоциации молекулы йода. Для этого:
- получить спектр излучения лампы накаливания,
- между конденсором и лампой накаливания установить кювету с кристаллическим йодом,
- на нагреватель кюветы подать напряжение 25–35 В и вести непрерывные наблюдения за происходящими изменениями в спектре,
- для улучшения качества молекулярного спектра необходимо уменьшить ширину входной щели монохроматора до 0,02–0,03 мм,
- определить границу сплошного спектра поглощения (предел сбегания полос), поставив острие указателя на последнюю видимую полосу. (Наблюдения проводятся в сине-зеленой области спектра). Снять отчет по барабану монохроматора. Проделать эту операцию 5–7 раз, найти среднее значение.
- пользуясь градуировочной кривой найти λгр,
- по формуле
D0 = hνгр – ΔW
вычислить энергию фотодиссоциации молекулы йода (ΔW для одного грамм-моля йода равна 89,7 кДж).
Контрольные вопросы
1. Выразите энергию двухатомной молекулы WАВ через энергии WА и WВ атомов А и В.
2. Почему спектр испускания (поглощения) молекул значительно сложнее спектра испускания (поглощения) атомов?
3. Как можно осуществить наблюдение молекулярного спектра поглощения?
4. Охарактеризуйте молекулярный спектр поглощения.
5. Объясните структуру молекулярного спектра поглощения, пользуясь энергетической диаграммой (рис. 6.1).
6. Какую информацию о состоянии и свойствах молекул получают, изучая молекулярные спектры поглощения?
Литература
[3] Фриш С.Э., Тиморева А.В. Курс общей физики. В 3-х т. Т. 3. 9-е изд. С.-Пб.: Лань, 2007. §§ 354, 355, 358.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.