Константа диссоциации не является постоянной, а представляет собой функцию концентрации электролита.
|
Таблица 4 |
||||
|
Константы диссоциации ряда электролитов при различных концентрациях |
||||
|
c, г-экв/л |
KCl К·102 |
MgSO4 К·103 |
NH4OH К·105 |
CH3COOH К·105 |
|
1,000·10-4 |
1,28 |
2,35 |
1,06 |
- |
|
2,000·10-4 |
1,96 |
3,23 |
- |
- |
|
2,879·10-4 |
- |
- |
- |
1,885 |
|
1,000·10-3 |
4,56 |
6,01 |
1,56 |
- |
|
1,151·10-3 |
- |
- |
- |
1,850 |
|
2,303·10-3 |
- |
- |
- |
1,849 |
|
5,000·10-3 |
10,51 |
10,46 |
- |
- |
|
1,000·10-2 |
15,10 |
13,29 |
1,68 |
- |
|
1,842·10-2 |
- |
- |
- |
1,849 |
|
3,685·10-2 |
- |
- |
- |
1,851 |
|
5,000·10-2 |
35,97 |
24,66 |
- |
- |
|
1,000·10-1 |
53,49 |
33,34 |
1,92 |
- |
Существенным недостатком теории Аррениуса является и то, что она не указывает причин, вызывающих ионизацию электролитов в растворах. Между тем в процессе ионизации расходуется значительное количество энергии. В этом можно убедиться на примере такого типичного электролита, как хлорид калия. Известно, что связь между атомами в молекуле хлорида калия электростатическая и в узлах его кристаллической решетки располагаются ионы калия и хлора. Энергию связи между ионами в отдельной молекуле можно представить в виде интеграла
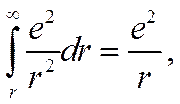 (1-23)
(1-23)
где r — расстояние между центрами ионов в молекуле, а е — заряд иона. Приняв r равным 2,79 Å, что отвечает постоянной решетки КС1, получим
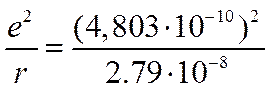
или в пересчете на грамм-молекулу
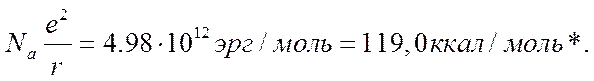
(Энергия решетки кристаллического КС1 будет, конечно, отличаться от этой величины. Однако точный расчет не изменит существенно конечных результатов).
В то же время средний запас тепловой энергии молекул при 25° С составляет около 3,4 ккал/моль. Используя эти величины и применяя формулу Больцмана, можно выразить число частиц п, обладающих достаточным запасом энергии для распада на ионы, через общее число частиц N хлорида калия
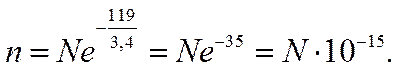
При этих условиях степень электролитической диссоциации, определяемая как соотношениe n/N, составляет 10-15.
Известно, что в водном растворе хлорида калия величина а близка к единице, т. е. почти каждая его молекула распадается на свободные ионы. Процесс растворения должен обеспечивать выделение энергии, достаточной для разрыва связей, существующих в молекуле до ее распада на ионы. Однако ни источник, ни природа этой дополнительной энергии не рассматриваются классической теорией электролитической диссоциации.
Ограниченность приложения теории электролитической диссоциации, несоответствие опытных величин а и К их физическому смыслу в рамках этой теории, неясность природы основного процесса не могли не вызвать ее критики. Суть этой критики и возможные пути усовершенствования теории растворов даны Д. И. Менделеевым. Он писал в «Основах химии», что главный порок теории электролитической диссоциации и вместе с тем причина всех ее недостатков заключается в игнорировании взаимодействия частиц растворенного вещества между собой, а также с молекулами растворителя. Он отмечал, что для растворов существенны не только процессы диссоциации, но и процессы образования новых соединений с участием молекул растворителя. Эти взгляды Д. И. Менделеева были развиты в конце прошлого и первой четверти настоящего столетия рядом ученых (Д. П. Коноваловым, И. А. Каблуковым, В. А. Кистяковским, Л. В. Писаржевским, А. Нойесом и др.) и легли в основу современной теории растворов. Количественное оформление идеи о взаимодействии между ионами и между ионами и частицами растворителя было дано значительно позже.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.