Министерство образования РФ
Санкт-Петербургский государственный горный институт
(технический университет)
Лабораторная работа № 6
Выполнил: студент гр. ММ-02
Дергачева Н.С.
Проверил: аспирант
Елдина Е.В.
2005
Цель работы: Фотометрическое определение концентрации вещества в растворе по измеренному значению оптической плотности при помощи калибровочного графика, построенного по серии стандартных растворов.
Сущность работы: Ион железа (III) с ионами ![]() тиоцианата, образует
комплексное соединение кроваво-красного цвета
тиоцианата, образует
комплексное соединение кроваво-красного цвета ![]() .
Раствор бледнеет вследствие восстановления ионов железа ионами роданида.
Поэтому фотометрировать раствор необходимо сразу же после приготовления.
Раствор окрашенного комплекса имеет максимум поглощения при длине волны 480 нм.
.
Раствор бледнеет вследствие восстановления ионов железа ионами роданида.
Поэтому фотометрировать раствор необходимо сразу же после приготовления.
Раствор окрашенного комплекса имеет максимум поглощения при длине волны 480 нм.
Приборы и реактивы:
Фотоколориметр КФК – 3.
Мерные колбы емкостью 50мл – 7 шт.
Пипетки градуированные на 1 и 10 мл
Стандартный раствор соли железа 0,1 г/л
Азотная кислота, разбавленная 1:1
Роданид аммония (или роданид калия), 10% -ный раствор.
Рабочий раствор соли железа 0,8 ммоль/л (готовится разбавлением стандартного раствора) – в колбе на 200 мл.
Задачи с исследуемым раствором с концентрацией по железу 0,5 – 5 мг/мл.
Выполнение работы:
Построение калибровочного графика
Концентрация стандартного раствора ![]()
Объём рабочего раствора ![]() .
.
Приготовив рабочий раствор путем разбавления стандартного раствора в соответствии с расчетом, разлили его по мерным колбам, емкостью 50 мл. Затем, последовательным добавлением в колбочки 0; 1; 2; 4; 6; 8; 10 мл рабочего раствора соли железа, добавили к нему 1 мл HNO3, потом ещё по 5 мл роданида аммония (или калия) в каждую колбочку. Для большего объем получаемого раствора, для необходимого его количества, долили в колбочки дистиллированной воды до метки и тщательно перемешивали до получения однородной массы.
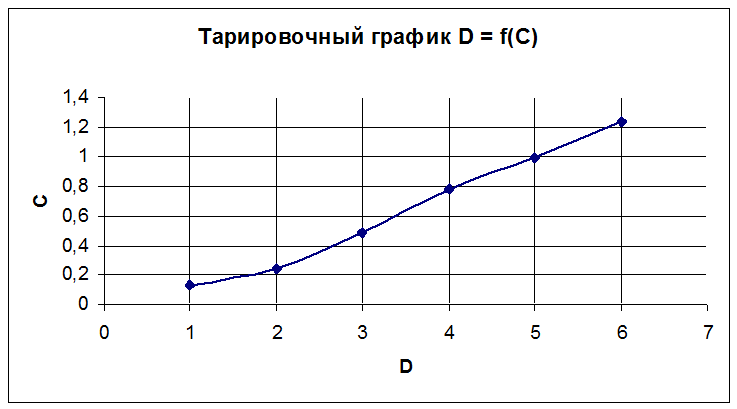
Потом, при помощи фотоколориметр КФК – 3 измерили оптические плотности растворов в кюветах с толщиной слоя 1 см. По полученным результатам измерений строим калибровочный график D = f(C).
Во время проведения анализа исследуемого раствора, задачи, пробу исследуемого раствора, содержащую 0,05 – 0,5 мг железа, поместили в мерную колбу на 50 мл. Далее повторили пункты по смешиванию и разбавлению раствора и определению оптической плотности раствора. Полученное значение отметили на калибровочном графике, и определили концентрацию исследуемого раствора.
Вычисление концентрации раствора:
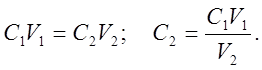
|
0 |
1 |
2 |
4 |
6 |
8 |
10 |
Задача |
|
|
D |
0 |
0,133 |
0,247 |
0,490 |
0,780 |
0,990 |
1,240 |
0,159 |
|
C |
0 |
16*10-6 |
32*10-6 |
64*10-6 |
96*10-6 |
128*10-6 |
160*10-6 |
22*10-6 |
Построение тарировочного графика D = f(C)
Порядок работы с фотоколориметром КФК-3
1. Одну из кювет заполнить раствором сравнения, другую – исследуемым раствором, начиная с наименее окрашенного.
2. Кюветы с растворами поместить в держатель и поставить в кюветное отделение прибора таким образом, чтобы раствор сравнения оказался дальним от исследователя.
3. Убедиться в том, что раствор сравнения находится напротив источника света (окуляр кюветного отделения).
4. Закрыть крышку кюветного отделения.
5. Установить длину волны 480 нм.
6. На панели прибора нажать клавишу «Г»
7. Нажать клавишу «Е»
8. Открыть крышку кюветного отделения.
9. Нажать клавишу «нуль»
10. Закрыть крышку кюветного отделения.
11. Нажать клавишу «Е»
12. Передвинуть рычаг кюветного отделения.
13. Считать на табло показание оптической плотности.
14. Вернуть рычаг в исходное положение.
15. Поменять исследуемый раствор и повторить п/п 12-14.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.