Химия.
Преподаватель – Иванов Иван Иванович
Заведующая лабораторией – Королева Галина Борисовна
Слушатель – Никифоров Михаил Николаевич
АПМ-03 Курс 1. Семестр осенний. 2003 год.
Химия – наука о веществах, их строении, свойствах, превращениях, сопровождающихся изменением свойств веществ.
Превращения бывают: 1) Физические (процессы,
сопровождаемые изменением физических свойств вещества). 2) Химические
(сопровождаются изменением строения атомов и молекул, составляющих вещество. В
результате образуются новые вещества с новыми свойствами. 2NaOH+H2SO4![]() Na2SO4 + 2H20 +
113,7 Дж (нейтрализация) 3) Физико-химические (не сопровождаются коренной
перестройкой атомов и молекул (плавление, испарение). 4) Ядерные
(сопровождаются коренной перестройкой атомов, приводят к возникновению новых
химических элементов)
Na2SO4 + 2H20 +
113,7 Дж (нейтрализация) 3) Физико-химические (не сопровождаются коренной
перестройкой атомов и молекул (плавление, испарение). 4) Ядерные
(сопровождаются коренной перестройкой атомов, приводят к возникновению новых
химических элементов)
Химические процессы классифицируются: 1) Синтез
(соединения): а) NH3+HCl![]() NH4Cl б) 2NO+O2
NH4Cl б) 2NO+O2 ![]() 2NO2 2) Реакция разложения (анализа) а) (NH4)2+Cr2O2
2NO2 2) Реакция разложения (анализа) а) (NH4)2+Cr2O2![]() Cr2O3+N2+4H2O+Q 3) Реакция обмена. Pb(CH3COO)2+2KI
Cr2O3+N2+4H2O+Q 3) Реакция обмена. Pb(CH3COO)2+2KI![]() PbI2+2KCH3COO 4) Реакция
вытеснения. CuSO4+Fe
PbI2+2KCH3COO 4) Реакция
вытеснения. CuSO4+Fe![]() Cu+FeSO4
5) ОВР (4)
Cu+FeSO4
5) ОВР (4)
Вещество – одно из состояний материй. Материя – вещество и энергия. Вещества бывают простые и сложные.
Элемент – вид атомов с одинаковым зарядом ядра = порядковому номеру.
Аллотропия – существование вещества в нескольких формах.
Полиморфизм – существование сложных веществ в нескольких формах (оксид кремния – 13 модификаций)
Основные законы химии
Эквивалент – количество
вещества, взаимодействующее с 1 молем атома водорода или замещающий его в
химических реакциях. Масса эквивалента, выраженная в граммах, называется эквивалентной
массой. [Э] [г/моль]. 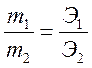 . В основаниях Э=М/2. В
кислотах Э=М/3. В солях Э=М/6. В оксидах Э=М/10.
. В основаниях Э=М/2. В
кислотах Э=М/3. В солях Э=М/6. В оксидах Э=М/10.
Моль – количество вещества, содержащее столько структурных единиц (атом, молекул, ион), сколько атомов в 12 г стабильного изотопа углерода C12.
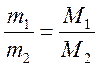 .
.
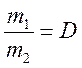 (плотность первого газа по второму).
(плотность первого газа по второму).Номенклатура неорганических соединений.
H – гидрогениум, C – карбониум, О – оксигениум, N – нитрогениум, Ag – аргениум, Mn – манганум, Si – силигениум, S – сульфид, Fe – феррум, Cu – купрум, As – арсигениум, Sn – стану, Sb – стибию, Hg – гидраргиум.
Вещества классифицируют по свойствам: 1) Оксиды (солеобразующие (основные, кислотные, амфотерные) и несолеобразующие). 2) Гидроксиды (основания и кислоты) 3) Соли.
Кислоты классифицируют на: 1) 1-основная 2) 2-основная 3) 3-основная 4) 4-основная.
1) Бескислородные 2) Кислородсодержащие.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.