Размерность К, см6/(моль2·с)
Процесс протекает при температуре 0 оС и атмосферном давлении (0,1 МПа).
Расход оксида азота 150 кг/ч, расход хлора 150 кг/час. Степень превращения реагента, взятого в недостатке, составляет 0,12.
Разложение циклогексана в газовой фазе
С6Н12 = 3 С2Н4
Процесс подчиняется кинетическому уравнению:
(-WA)= К·![]()
Зависимость константы скорости k(c-1) от температуры выражается уравнением Аррениуса, в котором lnk0 = 35,44; E = 310 кДж/моль.
Процесс протекает при температуре 950 оС и атмосферном давлении (0,1 МПа).
В реактор подаётся 5000 м3/ ч циклогексана в нормальных физических условиях и 5000 м3/час азота в тех же условиях. Степень превращения составляет 0,9.
Рассчитать объёмы реакторов РИВ и РИС-н.
Дивинил из циклогексана получают по реакции:
С6Н12 = 3/2С4Н6 + 3/2Н2,
которая происходит в газовой фазе и подчиняется кинетическому уравнению:
(-WA)= К·![]()
Зависимость константы скорости (c-1) от температуры выражается уравнением Аррениуса, в котором lnk0 = 32,29; E = 283 кДж/моль. Крекинг протекает при температуре 950 оС и атмосферном давлении (0,1 МПа). В реактор подаётся 10000 м3/ ч циклогексана в нормальных физических условиях и 2000 м3/час азота в нормальных физических условиях. Степень превращения составляет 0,9.
Рассчитать объёмы реакторов РИВ и РИС-н.
В проточном адиабатическом реакторе идеального смешения протекает обратимая экзотермическая реакция первого порядка типа
А → В
Константа скорости прямой реакции рассчитывается по уравнению:
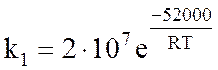 ч-1
ч-1
Константа равновесия реакции при 298 оС = 20.
Тепловой эффект реакции ∆H= - 65000 кДж/моль. В реактор объёмом Vр = м3
Реагенты поступают с объёмным расходом V0 = 0,5 м3/ч, начальной концентрацией САо = 1,5 кмоль/м3 и начальной температурой Т0 = 320 К.
Теплоемкость реакционной смеси Ср = 2,5 кДж/(кг·К), плотность ρ=800кг/м3.
Определить степень превращения достигаемую в реакторе. Какой должна быть начальная температура, чтобы достичь в реакторе максимальной скорости превращения?
Эндотермическая реакция первого порядка типа А→R протекает в адиабатическом реакторе идеального смешения непрерывного действия, имеющего объём VР = 1,5 м3. Тепловой эффект реакции ΔН = 195000 кДж/кмоль. Зависимость константы скорости от температуры выражается уравнением Аррениуса, в котором k0 = 7·107, E = 43000 Дж/моль. Реагент поступает в реактор с начальной концентрацией САо = 1 кмоль/м3, начальной температурой Т0 = 350 К и объёмном расходом V0 = 2,0 м3/ч. Средняя плотность реакционной смеси ρ = 940 кг/м3, теплоёмкость СР = 1,07 кДж/(кг·К), размерность k в ч-1.
Определить степень превращения и температуру, достигаемые в реакторе.
В реакторе идеального смешения проводится жидкофазная экзотермическая реакция первого порядка типа А→R+S, ΔН = -51200 кДж/кмоль. Константа скорости реакции равна k = 5,4∙105∙ехр(-47800/RT),c-1.
Объём реактора 1 м3, начальная концентрация раствора 4 кмоль/м3, скорость подачи раствора 0,005 м3/с. Теплоемкость раствора 3,73 кДж/(кг∙К), плотность раствора 1100 кг/м3. Оптимальная температура реакции 60 оС, температура реагентов на входе в реактор 25 оС. Определить площадь теплообменв, если известно, что температура охлаждающей воды 10 оС, Кт=320 Вт/(м2∙К).
Какую температуру необходимо поддерживать в реакторе идеального вытеснения, работающем в изотермическом режиме, и какова тепловая нагрузка на реактор, если в реакторе протекает реакция:
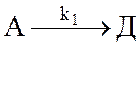 (ΔH = 28000
кДж·моль-1)
(ΔH = 28000
кДж·моль-1)
Степень превращения 0,65. Реакция первого порядка по веществу А и Д. Константа равновесия равна Кр = 1,6 при 298 К.
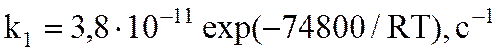
В реактор подаётся вещество А со скоростью V0 =3·10-3 м3·с-1 и концентрацией САо = 3 кмоль·м3. Время пребывания τ = 1,5 мин.
Протекают реакции:
А → R (1)
А → 2S (2)
Продукт R – целевой. Реакция (1) подчиняется кинетическому уравнению второго порядка (n1 = 2) , а реакция (2) – первого порядка (n2 = 1). Продукт R- целевой. Константы скорости реакций: К1 = 0,2 м3/(кмоль·ч); К2 = 1,6 ч-1.
Объёмный расход на входе в реактор V = 6 м3/ч. Степень превращения равна 0,8. Исходная концентрация реагента А САо = 2 кмоль/м3.
Выбрать реактор РИС или КРИС, обеспечивающий наибольший выход целевого продукта.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.