Адсорбція з розчинів більше складний процес тому, що необхідно враховувати, що крім розчиненої речовини адсорбуватися може й сам розчинник. Спостерігається якась конкуренція між адсорбентом і розчинником за «володіння » адсорбатом. І чим гірше адсорбується розчинник, тим краще адсорбується розчинена речовина. Адсорбція залежить від природи адсорбтива, від властивостей рідкого середовища, а також від природи адсорбенту. Найбільше значення при цьому відіграє взаємодія розчинника з поверхнею адсорбенту, яке характеризується кутом змочування. Рідина , що добре змочує поверхню адсорбенту заважає адсорбції на ній речовини – адсорбтиву. Цим пояснюється той факт, що полярні адсорбенти (наприклад глини), які добре змочуються водою, погано адсорбують розчинні речовини з водного середовища. Але глини добре адсорбують речовини з вуглеводневого середовища. Неполярний адсорбент – вугілля є добрим адсорбентом для поглинання речовин з водного середовища.
Адсорбція з розчинів відбувається повільніше чим з газів. Для прискорення часто застосовують перемішування. З підвищенням температури адсорбція звичайно зменшується
Правило - Панетта-Фаянса.
На поверхні твердого тіла з розчинів адсорбується той з іонів , що входить до складу кристалічної решітки або може утворювати з одним з іонів решітки малорозчинну сполуку.
Адсорбція одного з іонів, яка супроводжується витісненням з поверхні адсорбенту одно знакових іонів, називається іонообмінною. При цьому спостерігають процес поглинання адсорбентом іонів одного знаку , що супроводжується виходом з адсорбенту в розчин іонів того ж знаку. Схематично це можна представити так:
ХМ1+М2 ====ХМ2 + М1
Де Х – активне місце на поверхні адсорбенту;
М1 – іон, що витискується з адсорбенту.
М2 – іон, що поглинається з розчину і заряджений однаково з М1.
Ионообмінна адсорбція нагадує обмінні хімічні реакції, які відбуваються на поверхні твердої фази. При цьому тверда фаза поглинає з розчинів іони одного знака(катіони або аніони) і замість них виділяє в розчин еквівалентне число інших іонів того ж знака. Ионообмінна адсорбція має велике значення для с/г, тому що від природи поглинених ґрунтом катіонів залежить родючість
Кількісна залежність для обміну іонів з зарядом n1 і n2 визначається рівнянням Нікольського:
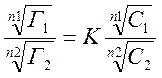
Де : Г1,Г2 – адсорбційні кількості іонів М1 і М2;
С1 і С2 - їх рівноважні концентрації в розчині.
Як показали дослідження, обмінні процеси в адсорбенті підлягають дії певних законів або правил:
1) адсорбція катіонів збільшується із збільшенням їх валентностей.
2) Для катіонів з однаковим значенням валентностей адсорбція збільшується із збільшенням радіуса не гідратованого іону.
За збільшенням гідродинамічного об’єму іони лужних та лужноземельних металів розташовані в ліотропний ряд:
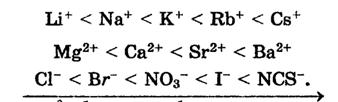
Зрозуміло, що у випадку адсорбції центр гідратованого іону літію буде знаходитися далі від поверхні адсорбенту, отже і його притяжіння до поверхні буде найменшим.
Отже можна зробити таки висновки:
Ємністю поглинання, або обмінною ємністю називають максимальну кількість іонів, яке поглинається обмінним шляхом певною масою адсорбенту , наприклад 1г. Ємність поглинання ґрунтів називають обмінною ємністю і визначають як кількість грам-еквівалентів іонів на 100 г ґрунту. Наприклад обмінна ємність звичайного суглинистого чорнозему 30мг-екв. на 100 г ґрунту.
Значення адсорбційних процесів.
Для освітлення бульйонів і відварів використовується сирий яєчний білок. У гарячому бульйоні він «згортається», утворюючи тверду пористу масу, на якій адсорбуються речовини, які надають бульйону каламутність. Слід зазначити, що наші смакові відчуття пов'язані з адсорбцією речовин на певних ділянках язику.
Термінологічний словник:
Поверхневий натяг - сила, що діє на лінію поверхні рідини і направлена на скорочення поверхні.
ПАР – поверхнево активні речовини - речовини, які адсорбуючись, накопичується на поверхні поділу, знижують поверхневий натяг даної межі поділу;
Адсорбент - Речовина, на поверхні якого відбувається адсорбція
Адсорбат - Речовина, яка адсорбується
Адсорбція - процес накопичення сторонніх молекул на поверхні поділу фаз, що супроводжується виділенням тепла.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.