Істинна поверхня адсорбенту, як правило, залишається невизначеною. Тому величину адсорбції визначають кількістю речовини, яка адсорбувалася одиницею маси адсорбенту. (моль/кг). Для того, щоб адсорбція була достатньо великою в практиці використовують як адсорбенти пористі тіла. Деревне та кісткове вугілля, активоване вугілля, силікагель. Вони мають велику питому поверхню. Так сучасне активоване вугілля має поверхню більш ніж 1000 м2 на 1 г вугілля. Така надзвичайно велика поверхня утворюється при спеціальній обробці. Завдяки чому у вугіллі виникає велика кількість дрібних пор , які й утворюють велику поверхню.
Тверде тіло може адсорбувати на своїй поверхні речовин як у вигляді молекул – молекулярна адсорбція, так і у вигляді іонів – іонна адсорбція.
Процес молекулярної адсорбції рідини чи газу на твердій поверхні при постійній температурі характеризується ізотермою адсорбції: по осі абсцис відкладають рівноважні концентрації речовини, що адсорбується , а по осі ординат – величину адсорбції
![]() Г
Г
 |
С
4. Рівняння, що описує процес
адсорбції називається рівнянням ізотерми адсорбції Легмюра: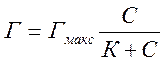
Де Г і Гм – кількість моль адсорбованої речовини на одиниці поверхні адсорбенту (Г в момент рівноваги; Гм – максимально можлива);
С- молярна концентрація речовини в момент адсорбційної рівноваги;
К – константа адсорбції.
При адсорбції з газового середовища величина С заміщується пропорційній їй величиною тиску Р.
Для середніх значень
концентрацій залежність адсорбції від концентрації описується простим
емпіричним рівнянням Фрейндліха: 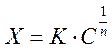 Х=
К*С1/n
Х=
К*С1/n
Де Х – кількість молей речовини, адсорбовані одиницею маси або поверхні адсорбенту;
С- рівноважна концентрація адсорбенту; К і n – константи для даного процесу.
Для знаходження констант К і n рівняння Фрейндлиха логарифмують: lgX = lgK + 1/n lgC
Одержане рівняння є рівнянням прямої лінії. По осі ординат відкладають значення lgX, а по осі абсцис – lgС . Відрізок , що відсікає пряма на осі ординат відповідає значенню lgК , а тангенс кута нахилу цієї прямої до осі абсцис дорівнює 1/n.
 lgx
lgx
![]() a
a
 |
lgK
lgC
Наведені рівняння дозволяють розрахувати адсорбцію даного адсорбату на даному адсорбенті.
Поляни в 1915 р. запропонував теорію полімолекулярної адсорбції.
Основні положення теорії Поляни:
1) адсорбція зумовлена суто фізичними силами;
2) на поверхні адсорбенту немає активних центрів, а адсорбційні сили діють поблизу поверхні і утворюють біля цієї поверхні безперервне силове поле;
3) адсорбційні сили діють на порівняно більші відстані, що перевищують розміри окремих молекул адсорбтиву і тому можна говорити про існування біля поверхні адсорбенту адсорбційного об’єму , який заповнюється молекулами адсорбтиву;
4) дія адсорбційних сил в міру віддалення від поверхні зменшується і на деякій відстані стає рівним нулю;
5) притяжіння даної молекули поверхнею адсорбенту не залежить від наявності в адсорбційному просторі інших молекул;
6) адсорбційні сили не залежать від температури і, отже, зі зміною температури адсорбція не змінюється;
7) під впливом адсорбційного поля виникає можливість утворення декількох шарів молекул адсорбату.
Найбільше притяжіння і стиснення відчуває перший адсорбційний шар. Притяжіння наступних шарів знижується до тих пір, поки густина речовини знизиться до його густині в навколишньому середовищі.
Теорія полімолекулярної адсорбції Поляни дозволяє описати адсорбцію на пористих адсорбентах та пояснити характер S-образної ізотерми.
Молекулярна адсорбція з розчинів.
Перші дослідження належать росіянинові вченому Т.Е. Ловицу(1785). Він уперше запропонував очищувати спирт від сивушних масел вугіллям.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.