ЛПЗ _1.1 Розв’язування задач на визначення осмотичного тиску, температур замерзання та кипіння розчинів. Ступінь дисоціації слабких електролітів
Мета: навчити студентів розраховувати концентрації розчинів. визначати осмотичний тиск, та температури кипіння та замерзання розчинів.
1. Типові завдання
Приклад 1. Скільки грамів хлориду натрію буде потрібно для приготування 1 л 10%-ного розчину, густина якого дорівнює 1,071(г/мл)? Як практично приготувати такий розчин?
Розв’язок
1. Визначимо масу розчину хлориду натрію, знаючи об’єм Vдорівнює 1л, або 1000 мл, а густина ρ =1,071 г/мл:
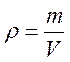 , звідки
, звідки ![]() ,
, ![]()
2. Обчислимо масу хлориду натрію в розчині, знаючи що масова частка солі ω становить 10%:
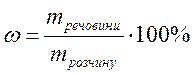 ,
звідки
,
звідки 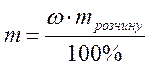
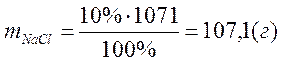
3. Для приготування 1 л 10% розчину хлориду натрію слід розчинити наважку кристалічного NaCl масою 107, 1 г невеликою кількістю дистильованої води в мірній колбі об’ємом 1 л. Після повного розчинення солі об’єм розчину доводять дистильованою водою до мітки на мірній колбі.
Відповідь: маса хлориду натрію 107,1 г.
2. Визначити температуру кипіння і замерзання 10%-ного водного розчину цукру C12H22О11. Кріоскопічна константа води дорівнює 1,86° С, а ебуліоскопічна 0,52° С.
Розв’язок
1. Нехай маса розчину 100 г, тоді в 100 г 10%-ного водного розчину міститься 10 г C12H22О11 і 90 г води (або 0,09 кг).
2. Користуючись ІІ законом Рауля визначимо зміну температури кипіння розчину:
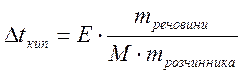 . М (C12H22О11)
= 342 г/моль
. М (C12H22О11)
= 342 г/моль
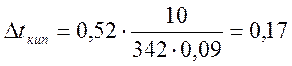 ˚С.
˚С.
3. Знаючи, що температура кипіння чистої води 100˚С, обчислимо температуру кипіння 10%-ного водного розчину цукру:
tкип = 100 + 0,17 = 100,17˚С
4. Користуючись ІІ законом Рауля визначимо зміну температури замерзання розчину:
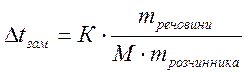 . М (C12H22О11)
= 342 г/моль
. М (C12H22О11)
= 342 г/моль
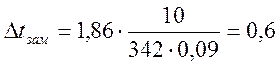 ˚С.
˚С.
5. Знаючи, що температура замерзання чистої води 0˚С, обчислимо температуру замерзання 10%-ного водного розчину цукру:
tзам = 0 - 0,6 = -0,6˚С
Відповідь: температура кипіння розчину 100,17˚С, температура замерзання розчину -0,6˚С.
3. Довідковий матеріал : таблиця розчинності
РОЗЧИННІСТЬ СОЛЕЙ І ОСНОВ У ВОДІ
(Р — розчинна речовина, М- малорозчинна речовина, Н — практично нерозчинна речовина, риска означає, що речовина не існує або розкладається водою)
|
Аніони |
Катіони |
||||||||||||||||||
|
Li+ |
Na, K+ |
NH4+ |
Cu2+ |
Ag+ |
Mg2+ |
Ca2+ |
Sr2+ |
Ba2+ |
Zn2+ |
Hg2+ |
Al3+ |
Sn2+ |
Pb2+ |
Bi3+ |
Cr3+ |
Mn2+ |
Fe3+ |
Fe2+ |
|
|
СІ- |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
М |
— |
Р |
Р |
Р |
Р |
|
Вг- |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Р |
Р |
Р |
М |
Р |
Р |
М |
— |
Р |
Р |
Р |
Р |
|
I- |
Р |
Р |
Р |
— |
Н |
Р |
Р |
Р |
Р |
Р |
Н |
Р |
Р |
Н |
— |
Р |
Н |
— |
Р |
|
NO3- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
— |
Р |
Р |
Р |
— |
Р |
Р |
|
СН3СОО- |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
Р |
— |
Р |
— |
— |
Р |
— |
Р |
|
S2- |
Р |
Р |
Р |
Н |
Н |
— |
Р |
Р |
Р |
Н |
Н |
— |
Н |
Н |
Н |
— |
Н |
Н |
Н |
|
SO32- |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
— |
— |
Н |
Н |
— |
Н |
— |
Н |
|
SO42- |
Р |
Р |
Р |
Р |
М |
Р |
М |
Н |
Н |
Р |
— |
Р |
Р |
Н |
— |
Р |
Р |
Р |
Р |
|
CO32- |
Р |
Р |
Р |
— |
Н |
Н |
Н |
Н |
Н |
Н |
— |
— |
— |
Н |
Н |
— |
Н |
— |
Н |
|
SiO32- |
Р |
Р |
— |
— |
— |
Н |
Н |
Н |
Н |
Н |
— |
Н |
— |
Н |
— |
— |
Н |
Н |
Н |
|
СгО42- |
Р |
Р |
Р |
Н |
Н |
Р |
М |
М |
Н |
Н |
Н |
— |
— |
Н |
Н |
Р |
Н |
— |
— |
|
РО43- |
Н |
Р |
Р |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
|
OH- |
Р |
Р |
Р |
Н |
— |
Н |
М |
М |
Р |
Н |
— |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
Н |
4. Запитання для самоперевірки.
1. При 25 С тиск насиченої пари води складає 3,166 кПа. Знайти тиск насиченої пари над 5% водим розчином карбаміда CO(NH2)2.
2. Розрахуйте температуру замерзання розчину , що містить в 250 г води 54г глюкози C6H12O6, якщо К води = 1,86.
3.Яким буде тиск пари розчину при 20 С , що містить 0,2 моль цукру і 450г води. Якщо тиск пари води = 17,5 мм.рт.ст.
4. Сформулюйте 1-й закон Рауля, запишіть математичний вираз цього закону.
5. Визначити осмотичний тиск 0,5 молярного розчину глюкози C6H12O6, при температурі 25 С.
6. При розчиненні 0,94 г фенолу в 50 г спирту температура кіпіння піднялась на 0,232 . Визначить молярну масу фенолу, якщо Е фенолу= 1,16
7. При 50 С тиск пари розчину , що містив в 200г розчину 23г речовини дорівнює 207,2 мм.рт.ст. Тиск чистого спирту 219,8 мм.рт.ст. Визначить молекулярну масу розчиненої речовини
8. Сформулюйте закон Вант-Гоффа про осмотичний тиск.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.