1. Кинетическое уравнение реакции первого порядка.
A ® продукты
Пусть в момент времени t = 0
CА=a
Если в момент времени t прореагировало х моль вещества А, то
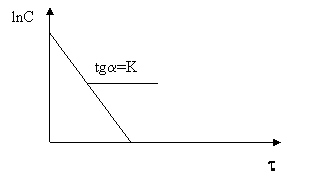 CА=(a-х)
CА=(a-х)
V=-dCА/dt
V=K*CА
-d(a-x)/dt=K(a-x)
dx/dt=K(a-x)
dx/a-x=Kdt
Проинтегрируем:
a òa-x dx/a-x=0òtKdt
ln(a/a-x)=Kt
Для реакции I порядка в координатной плоскости получается прямая, tg угла которой позволяет рассчитать константы скорости.
H2O Û H2O+1/2O2
Второй характеристикой реакции I порядка является период полураспада. Это время, через которое распалось половина первоначального количества вещества.
(a-x)=a/2
ln(a/(a/2))=Kt1/2
ln2= Kt1/2
2. Электролиз. Катодное нанесение покрытий и анодное растворение металла.
Электролиз – окислительно-восстановительная реакция, которая протекает на электродах при пропускании постоянного электрического тока через раствор или расплав электролита.
 На катод
- Na++e=Na0
На катод
- Na++e=Na0
На анод + 2Cl--2e=Cl2
NaCl расплав.
Na+Cl-
Щелочные, щелочноземельные металлы, редкоземельные, Al, малибден, Ti, Mg, W получают методом электролиза из расплава солей.
Электролиз водного раствора NaCl.
Na+, Cl-, H2O
На катод - Na++e=Na0 j0= -2,87B
H+2O+2e=H2+2OH- j0= -0,83B (по таблице окислительно-восстановительного потенцирования).
На катоде в первую очередь разряжается тот ион, для разряда которого надо приложить наименьшее электроотрицательное значение потенцирования.
(+)A 2Cl--2e=Cl2 j0= 1,36B
2H2O2--4e=O2+4H+ j0= 1,229B j0фактическое (H2O)= 1,6-1,8В
Согласно правилу разряда ионов на аноде разряжается тот ион, для разряда которого надо приложить наименьшее электроположительное значение потенцирования.
Однако существует явление перенапряжения.
m = jфактическое-jравновесное
Сдвиг потенциала от равновесного значения.
За счет перенапряжения на Аноде выделяется Cl.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.