Билет 10
1. 2(PbO)+ [PbS]= 3[Pb] + SO2↑
PSO2 = 0,5 атм.
aPbO = 0,3
aPb = 1
T = 1500 K
MPb = 207,2, MS = 32,6г/моль
Определить остаточную концентрацию PbS в свинце.
Решение:
ΔGo PbO = -181000 + 68 × 1500 К = - 79000 Дж/моль
ΔGo PbS = -144200 + 72,1 × 1500 К = - 36050 Дж/моль
ΔGo SO2 = - 361320 + 72,6 × 1500 K = - 252420 Дж/моль
Вычислим изменение стандартной энергии Гиббса реакции при температуре 1500К:
ΔGo = ΔGo SO2 – (2ΔGo PbO + ΔGo PbS) = -252420 + 2×79000+36050 = -58370 Дж
ΔGo = -RTlnKp
ln K = -ΔGo/RT = - (-58370)/8,31×1500 = 4,68
K = 107,77
Запишем выражение константы равновесия реакции:
K = 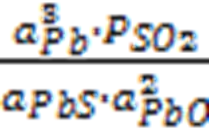
107,77 = 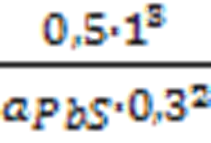
aPbS = 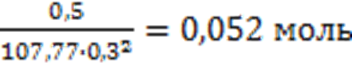
aPbS = XPbS Þ XPbS ![]()
m% PbS = 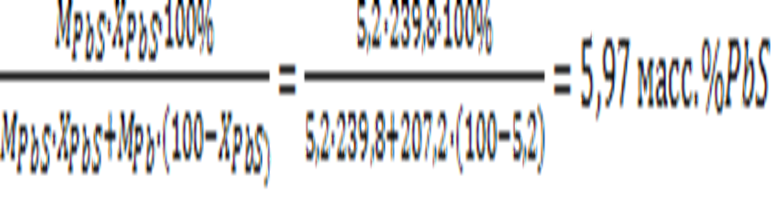
3. Способы получения стали
Существуют два способа получения стали:
- бессемеровский
- томасовский
При получении стали в качестве исходного продукта используется чугун. И из него выжигается углерод за счет подачи воздуха. По времени конвертирования можно определить остаточное содержание углерода.
Бессемеровский способ:
при этом способе конвертер футеруют кислыми огнеупорными материалами, которые могут разъедаться основными шлаками. Поэтому таким способом перерабатывают кремнистые чугуны, дающие кислый шлак. В бессемеровском способе можно наблюдать 3 периода работы конвертера:
1) окисление Si,Mn,Fe и образование кислого шлака.
2) после выгорания Si и Mn происходит окисление С и сгорание примесей.
3) в 3-ем периоде происходит полное выгорание Si,Mn,C и начинается сильное окисление Fe.
Затем в конвертер вводят раскислители, что уменьшает содержание О в Ме. И после раскисления сталь сливают.
Таким способом перерабатывают чугуны с высоким содержанием Si и низким содержанием S и Р.
При томасовском способе перерабатывают чугун с низким содержанием Si и высоким содержанием S и Р. В этом способе в конвертер загружают сначала известь, а затем заливают чугун. В конвертере образуется известковый шлак, необходимый для извлечения и связывания Р. В этом способе продувка чугуна чистым кислородом осуществляется не с днища (как в бессемеровском), а сверху. Это уменьшает угар и улучшает качество стали. Вводимый сверху кислород способствует сгоранию окиси С).
4. Bi12ZnO19-x
Уравнение Аррениуса:
Ď = Ďо ехр(-ΔЕD/RT)
ln Ď = ln Ďo – ΔЕD/RT × (1/T)
y = a – bx
|
T,K |
104/T, K-1 |
Ď´107 см2/с |
ln Ď (см2/с) |
|
950 |
10,5 |
8,30 |
18,23 |
|
1000 |
10 |
12,4 |
18,63 |
|
1050 |
9,52 |
13,7 |
18,73 |
|
1100 |
9,09 |
22,6 |
19,23 |
|
1150 |
8,70 |
30,5 |
19,53 |
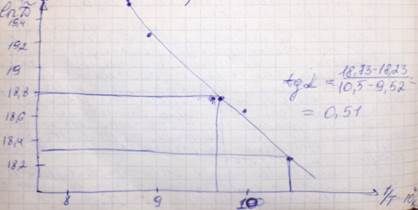
tga = 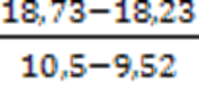 =0,51×104
=0,51×104
tga = ΔED/R
0,51×104 = ΔED/8,31
ΔED = tga×R = 0,51×104K×8,31 Дж/моль×К = 4,24×104 Дж/моль
Ďо = Ď ехр
![]()
Ďо = 8,30×107× ехр 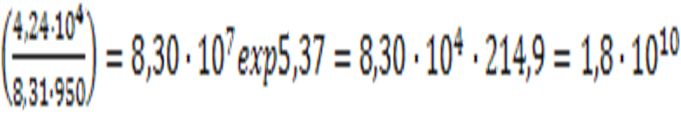
Ď =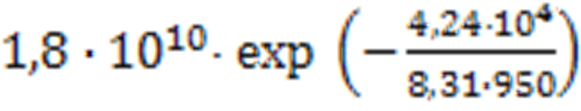
Между коэффициентом химической диффузии и коэффициентом самодиффузии существует различие, это различие довольно большое и достигает нескольких порядков, поэтому значения Ďо и Ď могут оказаться очень высокими.
Химическая диффузия – это диффузионный процесс в химическом поле, при котором градиент химического потенциала отличается от нуля.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.