Билет 18
1. [Mn] + (FeO) = MnOтв + [Fe]
m%Mn = 1 XMn = 1масс.%
γFeO = 20000XFeO+1
ΔGo FeO = -255810 + 53,63 × T
ΔGo MnO = -406200 + 87,9 × T
T = 1880 K
MMn = 54,94, MFe = 55,85 г/моль
Определить остаточное содержание кислорода в стали.
Решение:
ΔGo FeO = -255810 + 53,63 × 1880 К = - 154985,6 Дж/моль
ΔGo MnO = -406200 + 87,9 × 1880 К = - 240948 Дж/моль
Вычислим изменение стандартной энергии Гиббса реакции при температуре 1880К:
ΔGo = ΔGo MnO – ΔGo FeO = - 240948 – (-154985,6) = -85962,4 Дж
ΔGo = -RTlnKp
ln K = -ΔGo/RT = 85962,4 /8,31×1880 = 5,5
K = 244,69
Запишем выражение константы равновесия реакции:
K = 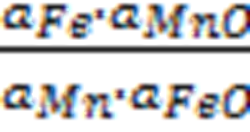
K = 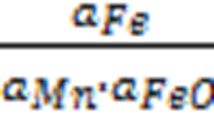
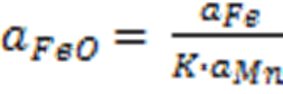
т.к. Mn и Fe образуют идеальный раствор Þ
aFeO
= 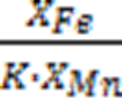
XMn = 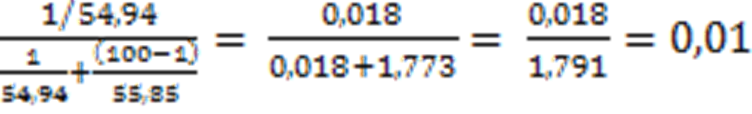
XFe = 1-0,01 = 0,99
aFeO
= 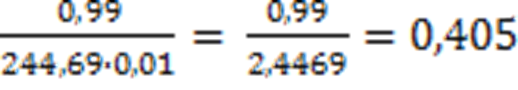
aFeO = XFeO × γFeO
XFeO = aFeO/ γFeO = 0,405/20000XFeO+1
(20000XFeO+1)XFeO = 0,405
20000X2 FeO+ XFeO – 0,405 = 0
D = 1 - 4×20000 (-0,405) = 32401
![]() =
180,003
=
180,003
x1
= 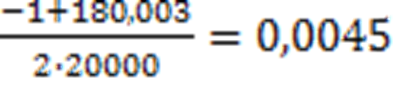
x2 = 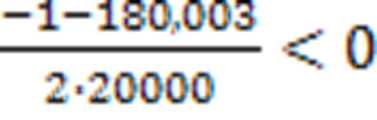
XFeO = 0,0045 моль = 0,45 масс. % или 0,225 % мол.[О]
3. Рентгеноспектральный анализ – возбуждение электронных уровней атомов под действием рентгеновских лучей.
Электроны с нижних оболочек переходят на верхние с поглощением энергии.
Рентгеноспектральный анализ определяет состав образцов (элементы).
Существуют:
- спектрометры;
- квантометры (для массового анализа образцов).
Схема спектрометра

Схема квантометра
4. Диаграмма фазового равновесия системы с устойчивым (конгруэнтно плавящимся) химическим соединением.
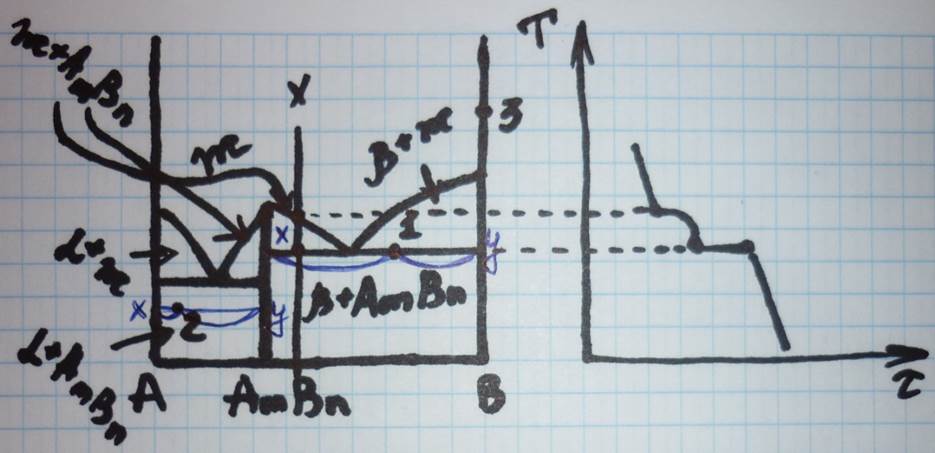
С1=2-3+1=0
С2=2-1+1=2
С3=2-1+1=2
т.1 т.2 т.3
------ ----- -----
Ф=3 Ф=1 Ф=1
1) β αтв.+ АmВn Втв.
2) ж.р. 6%В 94%А 100%
3) β+АmВn m=171г. m=829г. 1кг
28%В 72%А С=2-1+1=2 С=2-1+1=2
m=268г. m=732г. ax/xy∙1000=171г.
С=2-3+1=0 ay/xy∙1000=829г.
ax/xy∙1000=15/56∙1000=268г.
ay/xy∙1000=41/56∙1000=732г.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.