37. Электрохимические методы определения рН растворов.
1) при помощи водородного электрода
Водородный электрод – Н+ | Н2 , Pt – платиновая пластинка, погруженная в испытуемый р-р и омываемая струей водорода
Состояние равновесия H+ + e ↔ ½ H2
Составляют электрохимический элемент
(-) H2, Pt | H+ , A- || KCl | Hg2Cl2, Hg (+)
ЭДС этой цепи равна E = Eкал – EH+ | H2
где Eкал - потенциал каломельного электрода
EH+ | H2= -2,303b0pH
![]()
“+” простота аппаратуры, можно определять рН в р-рах, в кот.присутствуют окислители или восстановители, отсутствие необходимости калибровки прибора
“-” длительность измерения, получение газообразного водорода, электрод из платинированной платины легко «отравляется» примесями, область измерения в интервале рН от 1 до 8
2) с использованием хингидронного электрода
![]()
E0xr – стандартный потенциал хингидронного электрода
“+” простота аппаратуры, отсутствие необходимости калибровки прибора
“-” область измерения в интервале рН от 1 до 8, нельзя определять рН в р-рах, в кот.присутствуют окислители или восстановители
3) при помощи стеклянного электрода
Сосуд из тонкого стекла с повышенной электрической проводимостью, наполненный р-ром, в кот.погружен электрод 1-го или 2-го рода.
Eст = E0ст -2,303b0pH
где E0ст - потенциал стеклянного электрода
Составляют электрохимический элемент
(-) Hg, Hg2Cl2 | KCl aq || испытуемый р-р, Н+ | стеклянный электрод (+)
ЭДС этой цепи равна E = Eст – Eкал
![]()
38. Потенциометрическое титрование.
1) определение т/д характеристик хим.реакций
Измеряют э.д.с. цепи при различной температуре и определяют температурный коэф-т э.д.с. По этим данным рассчитывают изменение энергии Гиббса, энтальпии и энтропии.
2) определение средних ионных коэф-тов активности р-ров электролитов
Измеряют э.д.с. электрохимической цепи с одним электролитом (отсутствует диффузионный потенциал), электроды которой обратимы относительно катиона и аниона электролита.
3) определение стандартных потенциалов и констант равновесия электродных реакций
Измерив потенциал исследуемого электрода φ, можно рассчитать его стандартный потенциал φ0.
39. Определение понятий:
ν1А1+ν2А2+…+νnАn→ν’1A’1+ν’2A’2+…+ν’nA’n, где νi и ν’i – стехиометрич. коэф. исходных и полученных вещ-в
Аi и А’i- исходные и полученные вещ-ва.
υ=kcn1A1cn2A2…cnnAn
c – концентрации реагирующих вещ-в
Скорость реакции (υ) – кол-во молекул данного сорта, реагирующих в единицу времени.
Константа скорости реакции (k) – скорость реакции при условии, что концентрации реагирующих вещ-в равны 1. cA1=cA2=…=cAn=1, υ=k
Порядок реакции по данному вещ-ву – число, равное степени ni , в которой концентрация этого вещ-ва входит в кинетическое ур-ние реакции. Сумма степеней n1+n2+…+nn – порядок реакции в целом. Целое /дробное, положит./ отрицат.
Молекулярность – число молекул, участвующих в элементарном хим. акте (акт взаимодействия частиц, в рез-те кот. образуются новые частицы продуктов рекции или промежуточных соединений) всегда целое положит.
k=Ce-E/RT
Энергия активации (E) – тот избыток энергии по сравнению со средней энергии молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в хим. реакцию. Если E↑, то υ↓
Предэкпоненциальный множитель (C) – константа, характеризующая реакцию.
Время полураспада (τ): время, соответств. точке пересечения кривых.
х – прореагировавшее кол-во, а-х – оставшееся кол-во.
х=а/2 к моменту времени τ прореагирует половина исх. вещ-ва
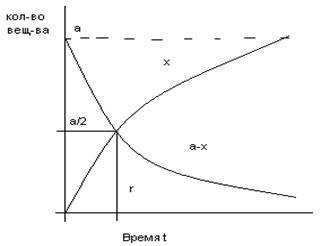
40. Вывод уравнения кинетики односторонней реакции 1 и 2 порядка.
1) А→В
![]()
![]() -
концентрация в-ва А в момент времени t, V объём системы
-
концентрация в-ва А в момент времени t, V объём системы
![]()
![]()
![]()
![]()
если t=0, x=0, то ![]()
![]()
![]() ,
c0 -
исходная концентрация, с - концентрация к моменту времени t
,
c0 -
исходная концентрация, с - концентрация к моменту времени t
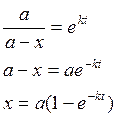
время полураспада х=а-х
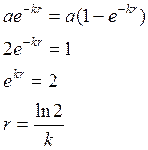 время
полураспада не зависит от количества исходного вещ-ва
время
полураспада не зависит от количества исходного вещ-ва
2) А+В→С+D+…
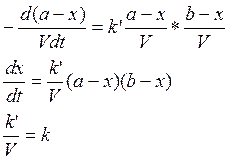 если
V=const, то
если
V=const, то
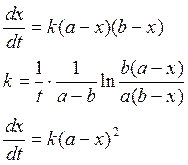 если
a=b, то
если
a=b, то
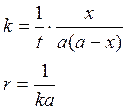 время
полураспада обратно пропорционально кол-ву исх.вещ-ва
время
полураспада обратно пропорционально кол-ву исх.вещ-ва
41. Вывод уравнения кинетики двусторонней реакции 1 порядка.
A k1↔k2 B
![]()
![]()
![]()
Принцип независимости: если в системе одновременно протекает несколько реакций, то каждая из них независима от остальных и скорость её прямо пропорциональна концентрации реагирующих веществ.
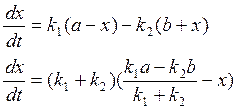
Пусть ![]()
тогда ![]()
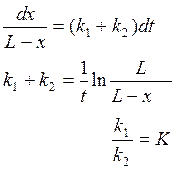
где К – константа равновесия
![]()
в момент равновесия ![]() тогда
тогда
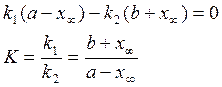
![]() где
х∞ - кол-во вещ-ва А, прореагировавшего к моменту равновесия
где
х∞ - кол-во вещ-ва А, прореагировавшего к моменту равновесия
Если считать как необратимую , то
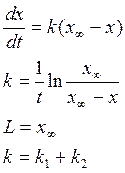
42. Вывод уравнения кинетики параллельных односторонних реакций
1 порядка.
Если исходные вещ-ва реагируют одновременно в нескольких направлениях, то такие реакции наз. параллельными.
А→B скорость
реакции ![]()
А→С скорость реакции ![]()
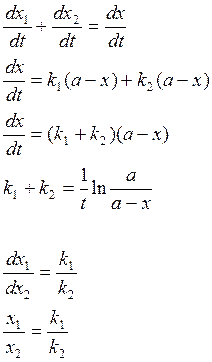
43. Кинетические кривые и уравнения скорости последовательной реакции.
Это реакции с промежуточными стадиями
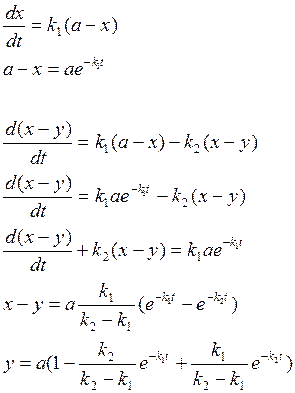
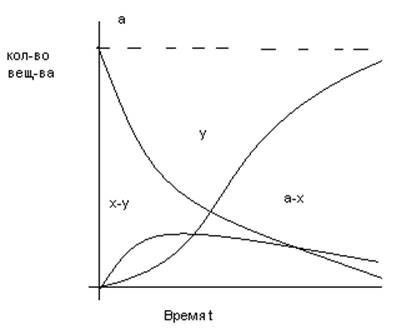
Кривая (x-y) изменения количества промежуточного вещ-ва имеет максимум tmax , при котором наиб. кол-во прмежуточ. вещ-ва
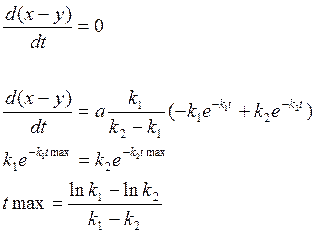
Пусть ![]() тогда
тогда
![]()
![]()
Чем больше k2/k1, тем больше ордината максимума (x-y)
y=f(t) характеризует накопление продукта: точка перегиба(т.е. вещ-во образуется с начальным ускорением) совпадает с точкой максимума (x-y)
44. Методы определения порядков реакции.
1) порядок реакции в целом = сумме порядков реакции по каждому вещ-ву
Порядок реакции по данному вещ-ву: изменение концентрации только данного вещ-ва, для этого концентрации остальных вещ-в должны быть велики, чтобы изменением их можно было пренебречь.
ν1А+ν2B+ν3C→ν4D+ν5E,
![]() ,
где k1=kcBn2cCn3,
,
где k1=kcBn2cCn3,
ni – степень, в кот. концентрация i-го вещ-ва входит в ур-ние реакции
2) по времени полураспада: задавать каждый раз исходную концентрацию данного вещ-ва (несколько опытов). Выяснить зависимость вр.полураспада от кол-ва исх.вещ-ва
n= n1+n1+…+ni – суммарный порядок реакции
r~![]() , где a – концентрация
исх.вещ-ва
, где a – концентрация
исх.вещ-ва
3) все вещ-ва, кроме А, берутся в избытке; задают 2 различных начальных значения концентрации:
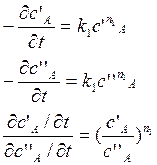
![]() порядок
реакции по вещ-ву А
порядок
реакции по вещ-ву А
4) графический:
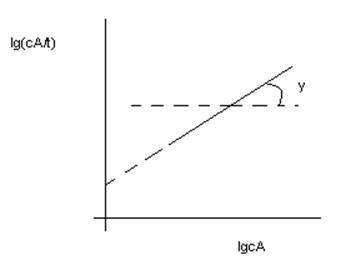 tgφ= порядку реакции по данному вещ-ву
tgφ= порядку реакции по данному вещ-ву
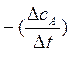 -
средняя скорость реакции
-
средняя скорость реакции
СА – концентрация вещ-ва А в каждый момент времени
5) метод подбора: проверяют, какое из ур-ний лучше описывает опытные данные. Ур-ние описывает процесс, если полученные по нему значения констант колеблются около какой-то средней величины.
45. Методы определения энергии активации.
Энергия активации (E) – тот избыток энергии по сравнению со средней энергии молекул при данной температуре, которой должны обладать молекулы, чтобы они могли вступить в хим. реакцию. Если E↑, то υ↓
![]() ур-ние Аррениуса
ур-ние Аррениуса
1) графический:
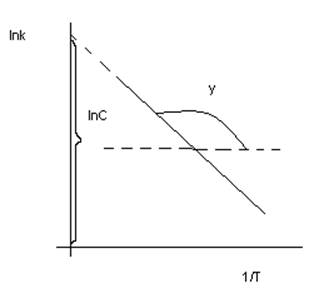
![]()
lnC – константа интегрирования
![]()
Отсюда определяем величину энергии активации.
2) по энергетическому барьеру:
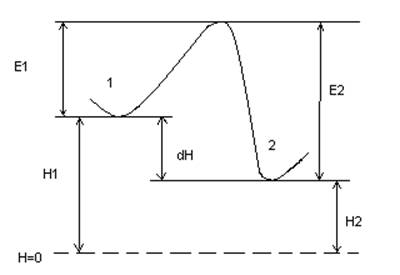 из состояния 1 в состояние 2 при затрате энергии Е1,
обратный переход при затрате энергии Е2
из состояния 1 в состояние 2 при затрате энергии Е1,
обратный переход при затрате энергии Е2
∆Н = Е2 - Е1
-∆Н = Н1 - Н2
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.