









Важнейшие биополимеры живой клетки
Введение
В отличие от синтетических высокомолекулярных соединений, которые производит современная химическая промышленность, высокомолекулярные соединения живой природы называются биологическими – биополимерами. Биополимеры образуются в процессе биосинтеза в клетках и являются важнейшими составными частями клеток всех живых организмов. К середине нашего столетия завершился почти полувековой этап расшифровки строения биополимеров.
Перечень биополимеров не так велик, это углеводы и сложные липиды, знакомые нам по предыдущему материалу; белки и нуклеиновые кислоты, к изучению химических основ строения и свойств которых мы приступаем.
a - Аминокислоты
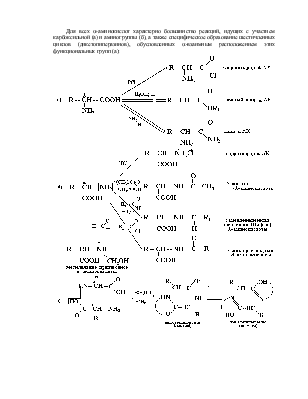
Аминокислоты являются важнейшими субстратами метаболизма азота в гетеротрофных организмах. От аминокислот берут начало белки, ферменты, пуриновые и пиримидиновые основания (и нуклеиновые кислоты), пиррольные производные (порфирины), биологически активные соединения пептидной природы (гормоны), а также ряд других соединений. В настоящее время в живых организмах обнаружено около 300 различных a-аминокислот. 20 из них являются постоянно встречающимися, генетически кодируемыми, остальные – явные или неявные производные этих аминокислот.
a-Аминокислоты – гетерофункциональные соединения, молекулы которых имеют карбоксильную (-СООН) и аминогруппу (-NH2), находящиеся у одного и того же углеродного атома.
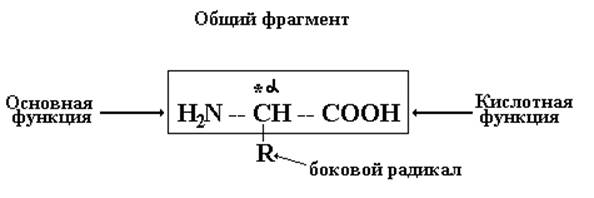
 Все a-аминокислоты
в соотвнтствии с определением, отличаясь боковыми радикалами, имеют общий
фрагмент, в котором a-углеродный атом
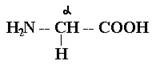
является ассиметричным (*С). Исключение составляет a-аминокислота глицин (аминоэтановая кислота) , формула которого
однозначно описывает молекулу соединения. Все остальные a-аминокислоты, имеющие хиральный центр (a*С), являются оптически активными соединениями и существуют в
виде двух стереоизомеров или оптических антиподов, относящихся друг к другу как
предмет к своему зеркальному изображению (энантиомеры).
Все a-аминокислоты
в соотвнтствии с определением, отличаясь боковыми радикалами, имеют общий
фрагмент, в котором a-углеродный атом
является ассиметричным (*С). Исключение составляет a-аминокислота глицин (аминоэтановая кислота) , формула которого
однозначно описывает молекулу соединения. Все остальные a-аминокислоты, имеющие хиральный центр (a*С), являются оптически активными соединениями и существуют в
виде двух стереоизомеров или оптических антиподов, относящихся друг к другу как
предмет к своему зеркальному изображению (энантиомеры).
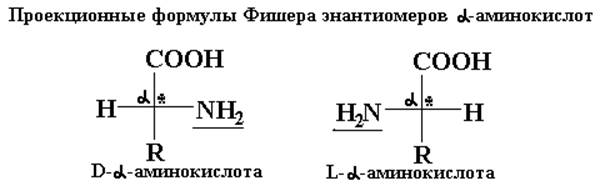
Относительная конфигурация энантиомера, имеющая расположенную справа группу NH2 (как у конфигурационного стандарта D-глицеринового альдегида), соответствует D-ряду a-аминокислот, а расположение NH2 –группы слева свидетельствует о принадлежности изомера к L-ряду a-аминокислот.
Все a-аминокислоты, входящие в состав белковой молекулы, принадлежат к L-ряду. a-Аминокислоты D-ряда называют иногда «неприродными», так как они не используются для построения белков человеческого организма. Однако D-a-аминокислоты довольно часто встречаются в клетках живых организмов. Так, например, в состав клеточной мембраны бактерии сибирской язвы входит D-глутаминовая кислота. Против такого вида бактерий бессильны расщепляющие ферменты человеческого организма.
У a-аминокислот разных стереохимических рядов наблюдается различие во вкусе, что свидетельствует об их стереоселективном взаимодействии со вкусовыми рецепторами. Так, например, в состав D-глутаминовая кислота безвкусна
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.