В отличие от большинства аминокислот для которых первой стадией катаболизма является переаминирование ни a-, ни e-аминогруппы L-лизина в этом процессе не участвуют. Катаболизм L-лизина начинается с конденсации лизина с кетоглутаровой кислотой с последующим восстановлением образовавшегося Шиффова основания при участии дегидрогеназы в сахаропин. Сахаропин окисляется другой дегидрогеназой и под влиянием гидролазы распадается на L-глутамат и L-a-аминоадипат-5-полуальдегид.
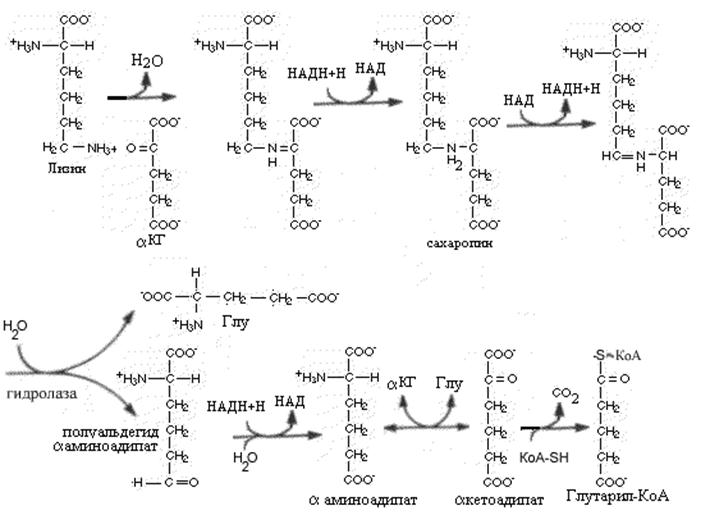 |
В ходе дальнейшего катаболизма полуальдегид восстанавливается в а-аминоадипат, который путем переаминирования превращается в а-кетоадипат и после окислительного декарбоксилирования последнего образуется глутарил-СоА. Лизин является одновременно и гликогенной, и кетогенной аминокислотой; природа же продуктов распада глутарил-КоА, образующихся в организме млекопитающих, не установлена.
Нарушение образования сахаропина приводит к гиперлинемии, которая может проявляться периодически (периодическая гиперлизинемия и сопутствующая гипераммониемия) или быть стойкой, но без проявлений гипераммониемии При периодической гиперлизинемии потребление белка в нормальных количествах может вызвать повышение концентрации лизина в тканях. Повышение лизина-конкурентного ингибитора аргиназы влечет за собой гипераммониемию.которая может быть причиной развития тяжелых кризов и коматозного состояния Увеличение потребления жидкости и снижение содержания лизина в диете понижают уровень гипераммониемии и ослабляют ее клинические проявления. Стойкая гиперлизинемия протекает без сопутствующей гипераммониемии. Наряду с блокадой процесса превращения лизина и а-кетоглутарата в сахаропин у некоторых пациентов, по-видимому, имелось нарушение превращения сахаропина в L-глутамат и а-аминоадипат-5-полуальдегид.
Аминокислоты можно синтезировать из простых предшественников
Важным и порой критическим для выживания клетки условием является обеспеченность всеми аминокислотами, необходимыми для синтеза белков и других азотсодержащих соединений. Способность синтезировать отдельные аминокислоты была утрачена в процессе эволюции некоторыми организмами и аминокислоты с этих позиций можно разделить на заменимые, т.е. синтезируемые данной клеткой и незаменимые – возможности синтеза которых ограничены и зависят от ряда условий. Даже микроорганизмы, сохранившие способность синтезировать все аминокислоты предпочитают получать их из своей среды. Это связано с тем, что процессы синтеза аминокислот требует значительных затрат энергии на биосинтез ферментов, участвующих в синтезе аминокислот и на сам процесс синтеза аминокислот. Поэтому образование ферментов путей синтеза и сами ферменты находятся под жестким регуляторным контролем и включаются лишь по мере необходимости.
Синтез отдельных аминокислот представляет собой сложный многоступенчатый процесс. Если сопоставить количество ферментов, необходимых для синтеза отдельных аминокислот, то становится очевидным, что в процессе эволюции в состав незаменимых попали аминокислоты образование которых требовало большого числа ферментов и энергетическое «содержание» таких процессов оказалось менее выгодным для выживания, чем зависимость от источников этих аминокислот. Тем не менее многие микроорганизмы и растения сохранили способность синтезировать все необходимые для них аминокислоты.
Число ферментов, необходимых для синтеза аминокислоты
|
Незаменимые |
Заменимые |
||
|
Аргинин |
7 |
Аланин |
1 |
|
Гистидин |
6 |
Аспартат |
1 |
|
Треонин |
6 |
Аспарагин |
1 (из Асп) |
|
Меитонин |
5 |
Глутамат |
1 |
|
Лизин |
8 |
Глутамин |
1 (изГлу) |
|
Изолейцин |
8 |
Пролин |
3 (из Глу) |
|
Валин |
1 |
Серин |
3 |
|
Лейцин |
3 |
Глицин |
1 (из Сер) |
|
Фенилаланин |
10 |
Цистеин |
2 (из Сер+S) |
|
Триптофан |
5 |
Тирозин |
1 (из Фен) |
|
Итого |
59 |
17 |
|
Пути синтеза аминокислот можно сгруппировать в несколько логичных модулей на основе или общности механизмов или на использовании общих ферментов, которые необходимы для синтеза нескольких аминокислот:
Для синтеза ароматических аминокислот, треонина и лизина, серина и глицина характерно общее начало с последующим разветвлением при образовании отдельной аминокислоты. Основным стратегическим принципом синтеза аминокислот является использование молекул «центральных» метаболических путей. Применение этого принципа вместо синтез аминокислот de novo дополнительный источник экономии энергии и уменьшения в течении эволюции количества генов, кодирующих ферменты путей синтеза аминокислот.
Организационно- Методические указания:
1.Мультимедийная презентация
доцент каф. Свергун В.Т.
Дата
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.