Тесная связь процессов обмена всех серусодержащих аминокислот позволяет нарушения их обмена свести в одну таблицу (см. таб.8-7). Нарушение процессов транспорта аминокислот в почках приводит к цистинурии (цистин-лизинурии). При этом наследуемом метаболическом заболевании резко (в 20-30 раз) увеличивается выделение цистина с мочой. Одновременно повышается также экскреция лизина, аргинина и орнитина. Увеличение у больных цистинурией выделения лизина, аргинина и орнитина позволяет высказать предположение о нарушении реабсорбции всех этих четырех аминокислот, что видимо связано с нарушением функции общего для них переносчика.
В почечных канальцах таких больных в силу низкой растворимости цистина может происходить образование цистиновых камней. В ряде случаев у больных с цистинурией обнаруживается смешанный дисульфид цистеина и гомоцистеина, который обладает более высокой растворимостью, что уменьшает вероятность образования камней. Возможно поэтому, цистинурия протекает сравнительно доброкачественно и во многих случаях остается недиагностируемой.
Плохая растворимость цистина лежит в основе еще одного наследственного заболевания цистиноза( болезнь накопления цистина) У таких больных происходит формирование кристаллов цистина во многих тканях и органах, что вызывает нарушение функции этих органов. Заболевание сопровождается общей аминоацидурией. Смерть обычно наступает в раннем возрасте при явлениях острой почечной недостаточности.
Нарушение обмена метионинапроявляется несколькими формами гомоцистинурии, при которой увеличивается выведение гомоцистин с мочой (до 300 мг в сутки) и повышается содержание метионина в плазме. В основе заболевания лежит нарушение активности ферментов, обеспечивающих метаболизм метионина. При гомоцистинурии типа 1 клиническими симптомами являются тромбоз, остеопороз, смещение хрусталика глаза и, часто, умственная отсталость. Известны две формы заболевания: витамин В6-чувствительная и витамин В6-нечувствительная. Диета с низким содержанием метионина и высоким содержанием цистина может предотвратить патологические изменения, если она соблюдается с раннего возраста.
Хотя цистеин и относится к группе заменимых аминокислот он образуется в клетке из метионина – незаменимой аминокислоты. У микроорганизмов синтез цистеина – двухступенчатая реакция .и происходит с участие серина и ацетил-КoA, которые соединяясь, образуют O-ацетилсерин, и после присоединения серы образуется цистеина.
Метионин незаменимая аминокислота для человека, у микроорганизмов синтезируется из оксалоацетата. В процессе участвует сукцинил-КоА и цистеин в качестве донора серы. Оксалоацетат сначала преобразуется в гомосерин (см синтез треонина). Гомосерин затем присоединяет серу в два этапа и метилирование завершает образование метионина.
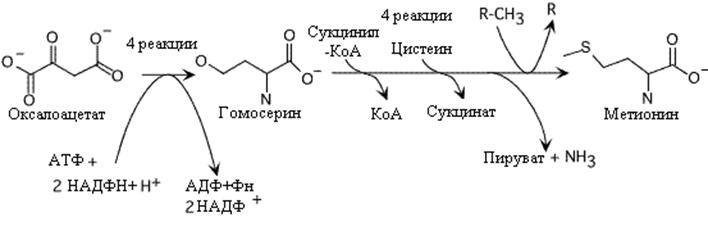
Синтез метионина. Донор метильной группы (R), N5,N10-метилен тетрагидроптероил.
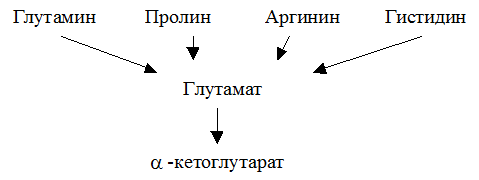
Основной член семейства a-кетоглутаровой кислоты – глутаминовая кислота
Глутаминовая кислота занимает важное место в промежуточном обмене нескольких аминокислот. К ним относятся глутамин, пролин, аргинин и гистидин.
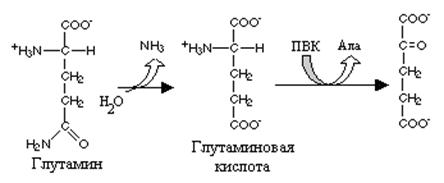
Реакция превращения глутамина в глутаминовую кислоту напоминает превращение аспарагина в аспарагиновую и катализируется глутаминазой. Учитывая, что глутамин - главная транспортная форма аммиака глутаминаза
 |
Синтез пролина включает четырехэтапный процесс, начинающийся с глютамата и представляет реакции обратные его распаду. Одна молекула АТФ и два НАДФH + Н+ используются на моль пролина.
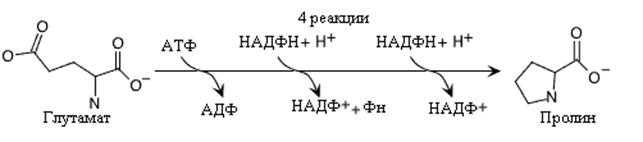
Синтез пролина.
Самое маленькое семейство у оксалацета
В оксалоацетат превращаются 2 аминокислоты аспарагин и аспарагиновая кислота. Два фермента катализируют это превращение. Аспарагиназа катализирует гидролитическое дезаминирование амидной группы аспарагина и образование аспарагиновой кислоты, а последняя под влиянием аспартатаминотрансферазы (АСТ) теряет аминогруппу и становится оксалоацетатом. Эта реакция обеспечивает цикл трикарбоновых кислот оксалоаце
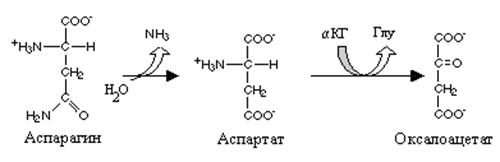 |
АСТ активна в сердечной мышце, что послужило основанием для применения препаратов, содержащих аспарагиновую кислоту в кардиологической клинике. Аспарагиназа используется при лечении некоторых форм аспарагина и образование аспарагиновой кислоты, а последняя под влиянием аспартатаминотрансферазы (АСТ) теряет аминогруппу и становится оксалоацетатом. Эта реакция обеспечивает цикл трикарбоновых кислот оксалоацетатом (анаплеротическая реакция). АСТ активна в сердечной мышце, что послужило основанием для применения препаратов, содержащих аспарагиновую кислоту в кардиологической клинике. Аспарагиназа используется при лечении некоторых форм лейкозов для разрушения аспарагина, который является незаменимой аминокислотой для отдельных форм предшественников лейкоцитов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.