При недостатке гистидазы в печени развивается гистидинемия, состояние которое наследуется по аутосомно-рецессивному пути. Большинство таких больных страдают умственной отсталостью и дефектами речи. Одновременно с повышением уровня гистидина в крови и моче наблюдается также возрастание выделения имидазолпирувата, который образуется в реакции переаминирования гистидина. Эта реакция альтернативного распада гистидина активируется в условиях блокады гистидазы. Цветную реакцию с FeCl2, которую используют для открытия фенилпирувата при диагностике фенилкетонурии дает и имидазолпируват ,что порой может служить причиной ошибочного диагноза фенилкетонурии
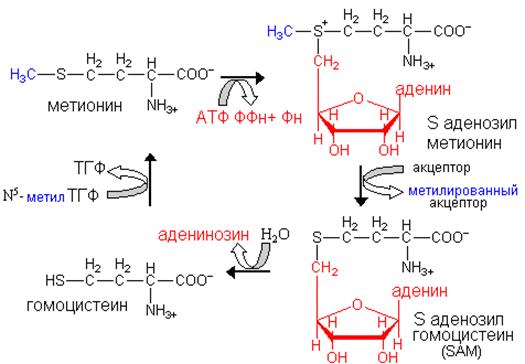
Серусодержащую аминокислоту метионин связывает с аминокислотами с разветвленным углеводородным радикалом общий конечный продукт, хотя пути к нему у
них значительно отличается. L-метионин на пути своего распада взаимодействует с АТФ с образованием S-аденозилметионина. Эту молекулу называют «активный метионин» поскольку он является донором метильной группы в синтезе многих важных для клетки соединений. После передачи метильной группы образуется S-аденозилгомоцистеин, который путем гидролиза S—С-связи распадается на L-гомоцистеин и аденин. Гомоцистеин используется в дальнейшем после конденсации с серином, для образования цистеина. Цистатионин–продукт этой конденсации гидролитически расщепляется на L-гомосерин и цистеин. Гомосериндезаминаза катализирует превращение гомосерина в а-кетобутират, который путем окислительного декарбоксилирования превращается пропионил-КоА.
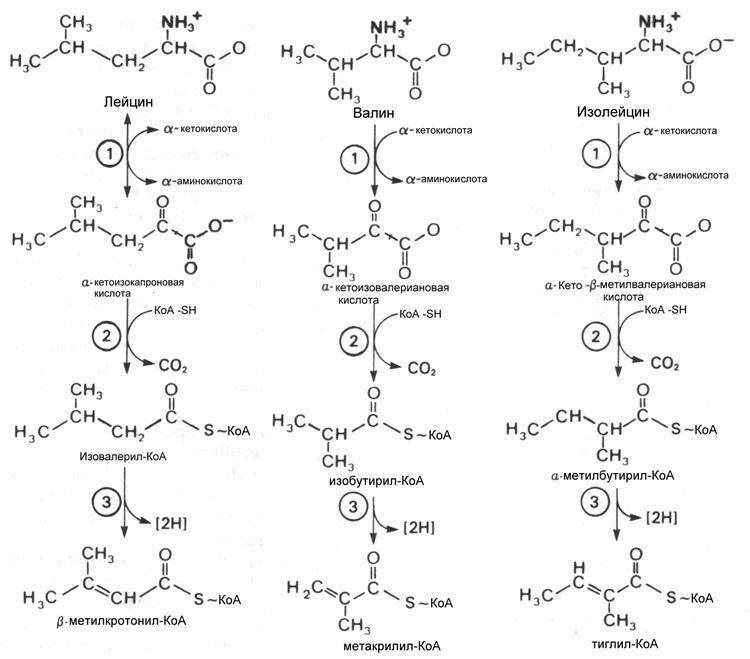 |
Хотя по конечному продукту катаболизма валин и изолейцин относятся к семейству сукцинил-КоА начальные реакции распада учитывая структурное сходство L-лейцина, L-валина и L-изолейцина одинаковы у всех аминокислот с разветвленным углеводородным радикалом, хотя затем пути их расходятся и валин становится источником глюкозы, лейцин – кетоновых тел , а изолейцин дает продукты для синтеза и глюкозы и кетоновых тел. Учитывая сходство начальных реакций катаболизма все три аминокислоты рассматриваются вместе.
Первый этап катаболизма – трансаминирование.. Эта реакция обратима и катализируется по-видимому одной и той же трансаминазой. a-кетокислоты- продукты переаминирования a-кетоизокапронат (из лейцина), a-кето-b-метилвалерат (из изолейцина) и a-кето-изовалериат (из валина) подвергаются окислительному дезаминированию при участии митохондриального полиферментного комплекса подобного пируватдегирогеназе и состоящего из таких же субъединиц и коферментов. Активность этого комплекса ингибируется при помощи протеинкиназы и активируется путем дефосфорилирования фосфопротеинфосфатазой. Кетокислоты являются регуляторами протеинкиназы.
Продукты окислительного декарбоксилирования представляют тиоэфиры КоА и подвергаются окислению путем дегидрирования, напоминающего дегидрирование линейных ацил-КоА тиоэфиров в процессе катаболизма жирных кислот. По-видимому существует несколько дегидрогеназ, катализирующих эту реакцию, о чем свидетельствуют наблюдения , что у больных с нзовалериановой ацидемией, после приема обогащенной белком пищи в крови накапливается изовалерат; хотя содержание других разветвленных а-кетокислот не повышается. Изовалериат образуется путем деацилирования изовалерил-КоА, являющегося субстратом упомянутой выше дегидрогеназы.
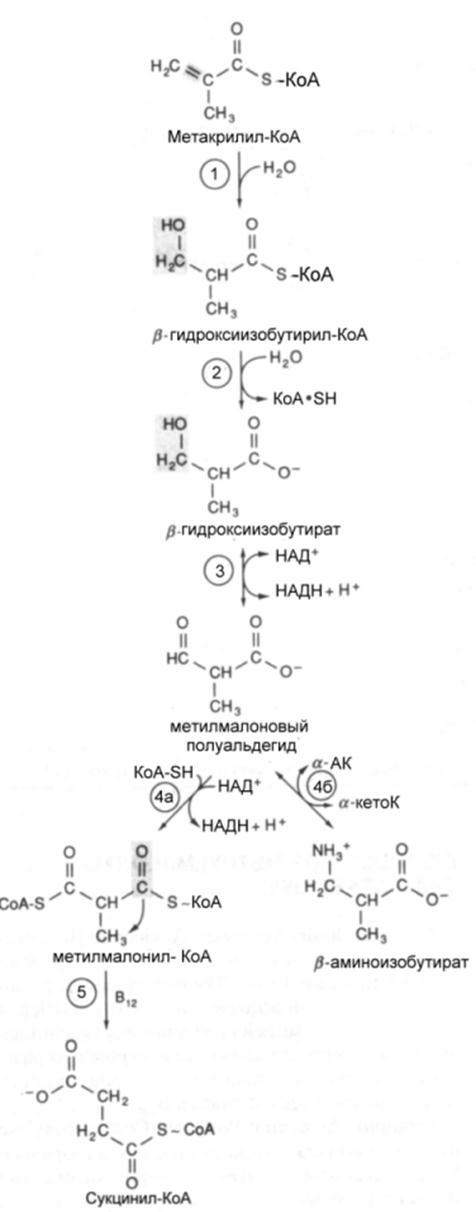
Продукт
реакции дегидрирования метилакрилил-КоА быстро гидратируется спонтанно или
под влиянием кротоназы, которая катализирует реакции с участием b-гидроксиацил-КоА , содержащих 4—9 атомов углерода. Образую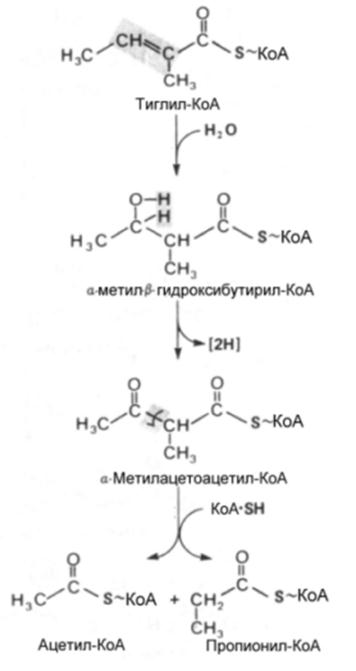 щийся
b-гидроксиизобутирил-КоА
сначала деацилируется при помощи деацилазы в b-гидроксиизобутират,
который затем окисляется при помощи НАД зависимой дегидрогеназы с
образованием метилмалонового альдегида. Реакция легко обратима. Дальнейший
метаболизм метилмалонового полуальдегида в тканях млекопитающих может идти по
двум путям: или путем переаминирования он превращается в b-аминоизобутират или окисляется в метилмалонат
с последующим образованием метилмалонил-СоА и изомеризацией последнего в сукцинил-СоА.
Переаминирование с образованием b-аминоизомасляной
кислоты , которая в норме присутствует
в моче,— осуществляется в различных тканях млекопитающих, в том числе в почках.
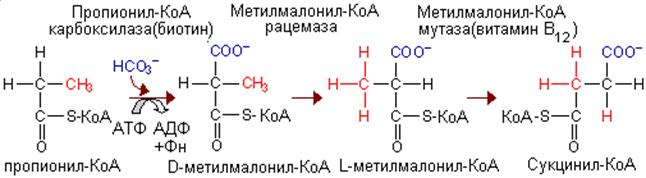
Изомеризация протекает при участии аденозилко-баламинового кофермента и она катализируется
ме-тилмалонил-КоА-мутазой.Эта реакция важна для катаболизма не
только валина, но и пропионил- КоА-катаболита изолейцина. При недостаточности
витамина В|2 активность мутазы снижается; у жвачных, использующих в
качестве источника энергии пропионат, образующийся при брожении в рубце,
щийся
b-гидроксиизобутирил-КоА
сначала деацилируется при помощи деацилазы в b-гидроксиизобутират,
который затем окисляется при помощи НАД зависимой дегидрогеназы с
образованием метилмалонового альдегида. Реакция легко обратима. Дальнейший
метаболизм метилмалонового полуальдегида в тканях млекопитающих может идти по
двум путям: или путем переаминирования он превращается в b-аминоизобутират или окисляется в метилмалонат
с последующим образованием метилмалонил-СоА и изомеризацией последнего в сукцинил-СоА.
Переаминирование с образованием b-аминоизомасляной
кислоты , которая в норме присутствует
в моче,— осуществляется в различных тканях млекопитающих, в том числе в почках.
Изомеризация протекает при участии аденозилко-баламинового кофермента и она катализируется
ме-тилмалонил-КоА-мутазой.Эта реакция важна для катаболизма не
только валина, но и пропионил- КоА-катаболита изолейцина. При недостаточности
витамина В|2 активность мутазы снижается; у жвачных, использующих в
качестве источника энергии пропионат, образующийся при брожении в рубце,
 |
 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.