Кристаллизация – это образование кристаллов из паров, растворов, расплавов, из вещества в твердом состоянии (аморфном или другом кристаллическом), из электролитов в процессе электролиза (электрокристаллизация), а также при химических реакциях. Для кристаллизации необходимо нарушение термодинамического равновесия в так называемой маточной среде – пересыщение раствора или пара, переохлаждение расплава и т. п. Пересыщение или переохлаждение, необходимые для кристаллизации, характеризуются отклонением температуры, концентрации, давления, электрического потенциала между фазами от их равновесных значений. В системах с химическими реакциями мерой пересыщения служит отклонение произведения давлений или концентрации компонентов от так называемой константы равновесия. Движущей силой электрокристаллизации служит разность потенциалов между металлом и раствором электролита, превышающая равновесную. В большинстве случаев скорость кристаллизации растет с увеличением отклонения от равновесия.
Кристаллизация – фазовый переход вещества из состояния переохлажденной (пересыщенной) маточной среды в кристаллическую фазу с меньшей свободной энергией. Избыточное теплосодержание выделяется в виде скрытой теплоты кристаллизации. Часть этой теплоты может превращаться в механическую работу; так, растущий кристалл может поднимать положенный на него груз, развивая давление порядка десятков кгс/см2 (например, кристаллы солей, образующиеся в порах бетонных плотин в морской воде, могут вызывать разрушение бетона). Выделение скрытой теплоты кристаллизации ведет к нагреванию расплава, уменьшению переохлаждения и замедлению кристаллизации, которая заканчивается исчерпанием вещества или достижением равновесных значений температуры, концентрации и давления. Процесс кристаллизации состоит из двух стадий: первая – образование зародышей кристаллизации, вторая – рост этих зародышей.
Зародыши кристаллизации.Переохлажденная среда может долго сохранять, не кристаллизуясь, неустойчивое метастабильное состояние, например мелкие (диаметром 0,1 мм) капли хорошо очищенных металлов можно переохладить до температур порядка 0,5Тпл. Однако при достижении некоторого предельного для данных условий критического переохлаждения в жидкости или паре возникает множество мелких кристалликов, называемых зародышами кристаллизации. Критическое переохлаждение зависит от температуры, концентрации, состава среды, ее объема, от присутствия в ней посторонних частиц – центров кристаллизации (пылинок, кристалликов других веществ и т.п., на которых образуются зародыши), от материала и состояния поверхности стенок сосуда, от интенсивности перемешивания, действия излучений и ультразвука.
Объединение частиц в кристаллические агрегаты уменьшает свободную энергию системы, а появление новой поверхности – увеличивает. Чем меньше агрегат, тем большая доля его частиц лежит на поверхности, тем больше роль поверхностной энергии. Поэтому с увеличением размера агрегата r работа А, требующаяся для его образования, вначале увеличивается, а затем падает (рисунок 1).
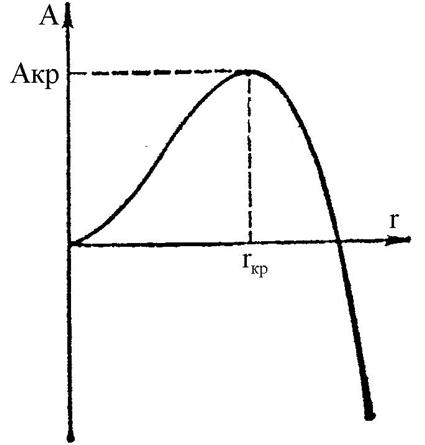
Рисунок 1 – Зависимость работы А, требующейся для образования кристаллического агрегата, от его размера r
Агрегат, для которого работа образования максимальна, называют критическим зародышем (rкр). Чем меньше работа образования зародышей, тем вероятнее его появление. С этим связано преимущественное зарождение на посторонних частицах (в особенности заряженных), на поверхностях твердых тел (главным образом на ее неоднородностях) и на их дефектах (гетерогенное зарождение). При этом кристаллики «декорируют» дефекты и неоднородности. Гомогенное зарождение в объеме чистой жидкости или газа возможно лишь при очень глубоких переохлаждениях. Критический зародыш и вырастающий из него монокристалл могут (особенно при очень глубоких переохлаждениях) иметь атомную структуру, отличную от структуры термодинамически устойчивой макрофазы. Например, Ga образует пять фаз, из которых устойчива только одна. С понижением температуры и с ростом переохлаждения уменьшается работа образования зародышей, но одновременно падает и вязкость жидкостей, а с нею и частота присоединения новых частиц к кристаллическим агрегатам. Поэтому зависимость скорости зарождения от температуры имеет максимум (рисунок 2). При низких температурах подвижность частиц жидкости столь мала, что расплав твердеет, оставаясь аморфным (см. стеклообразное состояние).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.