kО2~5.5·10-16 см3/(молек·с).
Возможна также реакция рекомбинации атомов кислорода в присутствии третьей частицы. Однако она протекает существенно медленнее, чем образование О3, опять-таки из-за малой частоты столкновений. Ею просто можно пренебречь.
Скорость образования озона уменьшается с понижением высоты и становится пренебрежимо малой при h<20 км вместе с исчезновением коротковолнового излучения, продуцирующего атомарный кислород. В тоже время фотолиз озона с разной эффективностью происходит на любой высоте[5]. На рис. 11.4 приведена оценка времени жизни атомарного кислорода, необходимого для производства озона, на разных высотах. С ростом высоты падает давление, падает частота столкновений атомов и молекул, следовательно, растет время жизни атомарного кислорода. Производство озона – один из основных процессов, сокращающих время жизни атомарного кислорода. Видно, что на высотах больших 40 км эффективность образования озона невысока, в то время как на высотах средней и нижней стратосферы время жизни атомарного кислорода очень мало, следовательно, образовавшиеся атомы кислорода очень быстро соединяются с молекулярным кислородом, образуя озон.
d[O3]/dt = kO3[O][O2][M] – JO3 [O3] – kO2[O][O3].
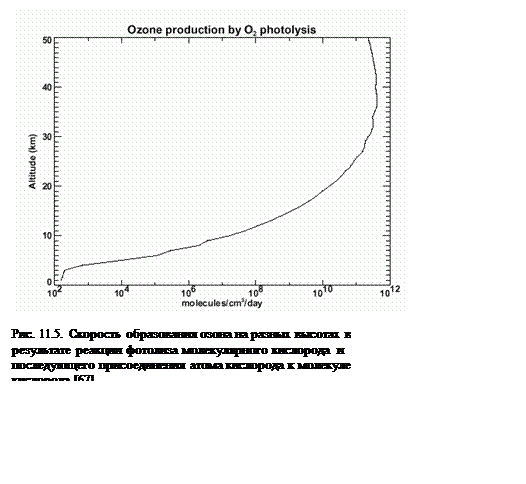
На рис. 11.5 показана приблизительная скорость производства озона на разных высотах (предыдущее выражение без учета членов, соответствующих процессам уничтожения газа). Видно, что скорость производства озона растет до высот около 40 км, затем начинает уменьшаться. Если же принять во внимание процессы разрушения озона (в основном за счет фотолиза ультрафиолетовым излучением) величина производной сильно уменьшается, и такое уменьшение наиболее эффективно выше 30 км.
Для концентрации атомарного кислорода О имеем
d[O]/dt = 2JO2 [O2] – kO3[O][O2][M] + JO3 [O3] – kO2[O][O3].
Складывая два уравнения, находим для изменения суммарной концентрации [O] и [O3]
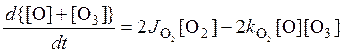 .
.
В зависимости от высоты здесь возможны упрощения. Так, для h~90 км [O3] << [O], и концентрацией О3 слева можно пренебречь:
d[O]/dt = 2JO2 [O2] – 2kO2[O][O3].
Наоборот, в стратосфере на высотах h ≈ 30 км [O] << [O3], и можно пренебречь d[O]/dt по сравнению с d[O3]/dt :
d[O3]/dt = 2JO2 [O2] – 2kO2[O][O3] (11.2)
Теперь надо оценить величину [О] и подставить в (11.2). Обратимся к исходному выражению для d[O]/dt. Ввиду малости концентрации атомарного кислорода на высотах стратосферы можно считать, что она почти не отличается от равновесной (производная d[O]/dt = 0). К тому же в дневное время процесс уничтожения озона в реакции О+О3 - медленный (им можно пренебречь) по сравнению с быстрым фотолизом О3 и образованием О3. Тогда
kО3[О][О2][М]=2JО2[О2]+ JО3[О3]. (11.3)
На высоте 30 км скорость фотолиза О3 на много порядков превосходит скорость фотолиза О2 (мала интенсивность коротковолнового ультрафиолетового излучения). Поэтому из (11.3) следует
[О]= JО3[О3] / (kO3[М][О2]),
то есть, концентрация атомарного кислорода определяется условием баланса между производством озона и его фотолизом. Подставим это выражение в (11.2):
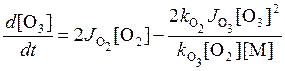 .
.
В условиях фотохимического равновесия отсюда находим
![]() .
.
 Чтобы воспользоваться последним
выражением для рисования профиля концентрации озона, важно знать время, за
которое устанавливается равновесие. Если это время велико, то тогда следует
обязательно учитывать процессы переноса в атмосфере, и можно ожидать, что рассчитанный
профиль будет отличаться от реального. Характерное время τeq
можно получить из соотношения
Чтобы воспользоваться последним
выражением для рисования профиля концентрации озона, важно знать время, за
которое устанавливается равновесие. Если это время велико, то тогда следует
обязательно учитывать процессы переноса в атмосфере, и можно ожидать, что рассчитанный
профиль будет отличаться от реального. Характерное время τeq
можно получить из соотношения
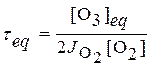 .
.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.