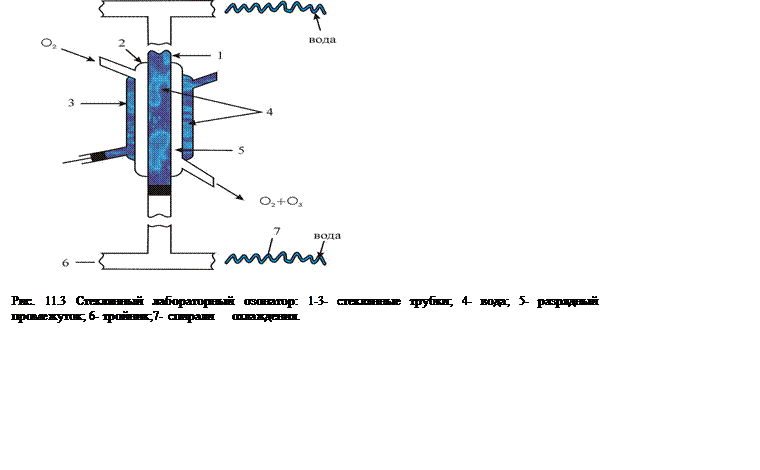
В настоящее время существует много конструкций промышленных озонаторов для получения больших количеств озона, используемого в технологических процессах. В лабораторных исследованиях чаще всего озон получают с помощью, так называемого, барьерного разряда. Под барьерным разрядом понимают разряд, возникающий между двумя диэлектриками или диэлектриком и металлом. Из-за того, что электрическая цепь разорвана диэлектриком, питание осуществляется только переменным током. Впервые озонатор, близкий к современным, был предложен в 1897 году немецким электротехником, иностранным членом-корреспондентом Петербургской академии наук Э. В. Сименсом (Ernest Vernier Siemens, 1816-1892). Конструкция, разработанная в Московском государственном университете и выполненная целиком из стекла, изображена на рисунке 11.3.
Озонатор состоит из трех трубок разного диаметра, вставленных друг в друга и спаянных по окружности. Во внутреннюю и наружную трубки (на рисунке 1 и 3 соответственно) наливается вода, нижние отводы трубок закрываются резиновыми пробками. Через пробки вводятся две проволоки, которые внутри трубок соприкасаются с водой. Водопроводная вода (не дистиллированная!) является проводником тока, так что трубки 1 и 3 оказываются под напряжением. Электропитание осуществляется от высоковольтного трансформатора. Земляной провод высоковольтной обмотки трансформатора подается на внешнюю трубку, на этом же участке цепи ставят измеритель тока (миллиамперметр); высоковольтный провод подводится к внутренней трубке.
Озон изогнутая молекула в виде равнобедренного треугольника с углом в вершине116.8 ° и Ro-o≈1.3 Ао. Энергия связи D(О-О2)=1.5 эВ. Это совсем немного, поэтому практически любое поглощение излучения с длиной волны λ<900 нм может привести к диссоциации молекулы.
Молекула озона сильно поглощает в области 200-320 нм, слабое поглощение имеется вплоть до 360 нм, а также в области 440-850 нм и около 1100 нм. Кроме этого имеется поглощение, не приводящее к разрушению молекулы, в микроволновой области спектра.
Фотолиз О3 достаточно детально изучен. На примере озона интересно проследить различные механизмы этого процесса. Например, интересно, что квантовый выход фотолиза О3 в озоно-кислородной смеси получается обычно большим единицы.
Так, считается, что при поглощении красного света ηО3=2. Как это понимать? Такой результат получается, когда наряду с первичным актом фотолиза учитывают быстропротекающие реакции с участием продуктов распада молекулы. В частности, для данного случая предполагается следующая схема:
О3+hν(≈600 нм)→О+О2,
О+О3→2О2. (11.1)
При этом, как показывают эксперименты, продукты всех реакций получаются в основном состоянии. Если бы вторая реакция шла медленно или можно было создать условия, когда она не идет, то получилось бы η=1. А так - η=2. Кстати, для этой схемы квантовый выход О2 равен трем.
Совершенно иначе идет фотолиз О3 при облучении ультрафиолетовым излучением. В частности, при λ=334.0 нм ηО3=4. Это указывает на то, что среди продуктов фотолиза должны быть возбужденные частицы, способные и дальше разлагать О3. Предполагалась, например, следующая схема
О3+hν(334 нм)→О(1D)+О2,
О(1D)+О3→О2+2О.
Два атома О в основном состоянии разлагают еще две молекулы О3 по схеме (11.1). Однако с помощью лабораторных опытов удалось показать, что это не так. Дело в том, что возбужденный атом кислорода О(1D) очень эффективно гасится (переводится в основное состояние) молекулярным азотом. Поэтому следует ожидать, что добавление N2 должно уменьшить квантовый выход с 4 до 2. Но этого не происходит. Отсюда делается вывод, что возбужденной частицей должен быть молекулярный кислород, а именно:
О3+hν(334 нм)→О+О2*,
О+О3→2О2,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.