диффузионном и диффузно- кинетическом контроле коррозионного процесса.
Возникают аэрационные пары в результате неравномерного подвода кислорода к отдельным участкам поверхности металла. Т. е. отдельные участки металла
соприкасаются с растворами имеющими различные концентрации О2. Мы имеем концентрационный кислородный элемент.
Участки к которым облегчен доступ кислорода работают как катоды.
В тоже время на менее аэрируемых участках протекает анодный процесс.
Работой аэрационных паров обусловлен эффект усиленного разрушения металла в условиях неполного погружения.
ПАССИВНОСТЬ МЕТАЛЛОВ
Пассивность металлов – состояние относительно высокой коррозионной стойкости, вызванное торможением анодного процесса электродной коррозии. Повышенная коррозионная стойкость металлов может быть обусловлена различными причинами, в частности термодинамической устойчивостью, т.е. инертностью Ме, отсутствием в электролите деполяризатора или затрудненностью его доставки к поверхности Ме, торможением катодного процесса. Однако под пассивностью подразумевается только повышенная стойкоть, вызванная анодным торможением.
![]()
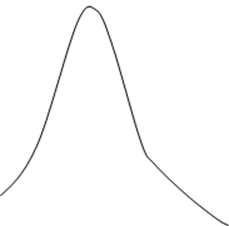 Типичным
примером или как принято называть классическим примером скорость
коррозии может
служить резкое уменьшение скорости
Типичным
примером или как принято называть классическим примером скорость
коррозии может
служить резкое уменьшение скорости
![]()
![]()
![]() г/м2час 104
коррозии Fe в растворе азотной кислоты с увеличением ее
концентрации, которую наблюдал впервые еще Ломоносов в 1738 году.
г/м2час 104
коррозии Fe в растворе азотной кислоты с увеличением ее
концентрации, которую наблюдал впервые еще Ломоносов в 1738 году.
Пассивность наблюдается в определенных
условиях у многих металлов.
![]()
![]() 40
40
HNO3 50 %
Характеристика пассивного состояния металла
Наступление пассивного состояния металла характеризуется следующими
явлениями:
а) режим уменьшения скорости коррозии;
б) значительным смещением потенциала металла в положительную сторону
Fe -(0,2-0,5) B до +(0,5-1) В
Cr -(0,4-0,6) B до +(0,9) В
Смещение потенциала указывает, что при наступлении пассивности затормаживается протекания анодного процесса электрохимической коррозии, т.е.высока степень анодного контроля.
Пассиваторая и депассиваторы
Вещества или процессы, вызывающие в определенных условиях наступление
Пассивного состояния металла называются и пассивными факторами.
Пассиваторами являются:
1. Окислители: HNO3, NaNO3, NaNO2, K2Cr2O7, O2;
2. Анодная поляризация от внешнего источника тока или при работе данного металла, которая в определенных условиях т.е. при определенной плотности тока может вызвать наступление пассивного состояния металла
При изменении внешних условий пассивный металл может перейти в активное состояние. Этот процесс называется депассивацией или активацией.
Вещества или процессы нарушающие пассивное состояние металла илизатрудняющие наступление пассивности называют называют депассиваторами или активаторами.
Депассиваторами являются:
1. Восстановители: H2, na2SO4, Na2S2O3и др.
2. Катодная поляризация.
3. Некоторые ионы Cl, Br-, I-, SO4 и др.
4. Повышение температуры.
5. Механическое разрушение пассивной поверхности металла, если Ме не находится в пассивирующей среде.
Теория пассивности металлов
И связи с трудностью объяснения всей совокупности явлений происходящих при пассивации и депассивации металлов предложено много теорий.
Наиболее распространенными и признанными являются две теории:
- пленочная;
-адсорбционная.
Пленочная теория пассивности металлов
Пленочная теория пассивности металла объясняет пассивное состояние металлов возникновением тончайшей, часто невидимой защитной пленки продуктов взаимодействия металлов с окислителями.
Чаще всего эта пленка представляет собой окислы
Fe3O4 или Fe8O4 на Fe в HNO3
Cr2O3 и CrO2 на Cr в кислых средах
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.