![]()
![]()


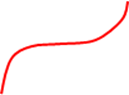 А Участок А-
деполяризация катода по одной
А Участок А-
деполяризация катода по одной
1 i из указанных нами реакций
O2 +4e +2H2O =4OH--
O2 + 4e +4H+ = 2H2O
При этих плотностях тока количество восстанавливаемого кислорода в единицу времени , меньше максимально возможной скорости подвода кислорода путем диффузии
На данном участке скорость процесса коррозии ограничивается
замедленностью самого процесса восстановления кислорода, т.е. при данных плотностях тока лимитирующей будет химическая поляризация – перенапряжение ионизации кислорода υ(тета).
![]()
![]() Перенапряжение ионизации кислорода зависит от материала катода,
плотности тока и температуры. t υ .
Перенапряжение ионизации кислорода зависит от материала катода,
плотности тока и температуры. t υ .
При малых плотностях тока iK< 10-2a/м2 перенапряжение ионизации кислорода имеет линейную зависимость от плотности тока
υ = k iK
где k-const, зависящая от материала и состояния поверхности катода, температуры и других факторов.
При больших плотностях тока iK > 10 -2 a/м2 и достаточно высоких скоростях
подвода кислорода перенапряжение ионизации кислорода находится в логарифмической зависимости от плотности тока
υ =а1 +
b1![]() K
K
где а1-const, а1= υ при iK=1 зависит от материала и состояния поверхности катода, температуры и других факторов;
b1= RT/![]() 2,303 при 25 оС, n = 1 b1 =0,116
2,303 при 25 оС, n = 1 b1 =0,116
где b1- const не зависящая от материала катода, определяется только механизмом катодной реакции.
При дальнейшем увеличении плотности тока потенциал катода начинает смещаться довольно быстро в отрицательную сторону- имеет место.
Довольно высокая величина концентрационной поляризации при коррозии металла с кислородной деполяризацией объясняется малой скоростью подвода кислорода вследствие малой растворимости его в воде и водных растворах.
Иногда диффузия кислорода к поверхности металла затрудняют труднорастворимые вторичные продукты коррозии.
Концентрационную поляризацию можно вычислить по уравнению
|
|
RT |
ln |
Co2 |
- в объёме |
|
nF |
Co2` |
- у поверхности |
|
|
RT |
ln(1- |
iK |
) |
|
nF |
iq` |
где iq- предельная диффузионная плотность тока по кислороду, которая определяется экспериментально или рассчитывается.
Концентрационная поляризация увеличивает смещение потенциала катода
в отрицательную сторону
![]() φK= (а1 + b1lgiK)-b1lg(1 –iK
/ iq )
φK= (а1 + b1lgiK)-b1lg(1 –iK
/ iq )
При определенных плотностях тока( при плотностях тока близких к iK) потенциал катода изменяется скачком. Резкое смещение потенциала соответствует такому положению, когда используется весь кислород, который поступает за счет диффузии.
При определенном потенциале на катоде может начаться новый процесс. В
водных растворах таким процессом как правило является процесс разряда ионов
водорода. Протекает коррозия с водородной деполяризацией.
Характерные особенности коррозии металлов с кислородной деполяризацией
Мы уже отмечали с вами, что в зависимости от условий коррозии наиболее затрудненными стадиями являются:
1. ионизация кислорода (кинетический контроль);
2. диффузия кислорода (диффузионный контроль);
3. одновременно и диффузионный ионизация кислорода (диффузионно-кинетический контроль).
Коррозия металла с каждым из этих контролей имеет свои особенности. Кинетический контроль
Контроль перенапряжением ионизации кислорода имеет место при сравнительно малых плотностях тока и бодьших скоростях подвода кислорода:
а) при сильном перемешивании;
б) при очень тонкой пленке на поверхности металла(при влажной атмосферной коррозии).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.