следует из совпадения энергий связи и теплот образования изотопных разновидностей химических форм, участвующих в обмене. Следствием является строгая изотермичность процессов изотопного обмена и независимость константы равновесия от температуры. Действительно:
|
DG0 = DH0 - TDS0 = -RT ln Kp, |
(3.3) |
где DG0, DH0, DS0 — изменения стандартных энергии Гиббса, энтальпии и энтропии соответственно. Отсюда
ln Kp = -DH / RT + DS / R.
Дифференцируя это выражение, получим
DH = 0,
то d(ln Kp) / d T = 0.
d(ln Kp) / d T = - DH / RT2.
Поскольку ,т. е. константа равновесия реакций идеального изотопного обмена не зависит от температуры.
Как следует из рассмотрения термодинамического поведения изотопных атомов, в случае идеального обмена DG0 = 0. Принимая во внимание, что для этих процессов DH0 = 0, из соотношения (3.3) следует, что DS0 = 0 и константа равновесия реакций идеального изотопного обмена равна единице. Поэтому состоянию равновесия реакций идеального изотопного обмена отвечает равнораспределение изотопов между обменивающимися формами, т. е. идентичность изотопного состава этих форм. Действительно, если
![]()
то
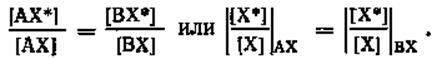
Одной из основных кинетических особенностей процессов идеального изотопного обмена является постоянство общей скорости обмена атомами данного элемента между всеми изотопными разновидностями, участвующими в обмене. Это постоянство обусловлено отсутствием химических изменений, неизменностью концентраций веществ, участвующих в обмене, и постоянством констант скорости обмена для различных идеальных изотопов данного элемента.
Другими кинетическими особенностями реакций
идеального изотопного обмена являются:
1) идентичность механизма прямой и обратной реакций как результат совпадения
характера и энергий взаимодействия изотопных частиц;
2) совпадение порядка прямой и обратной реакций, являющееся следствием
идентичности механизма и полной симметричности этих реакций;
3) равенство энергий активации прямой и обратной реакций как результат
совпадения свободных энергий образования переходных комплексов и
взаимодействующих изотопных частиц;
4) совпадение констант скоростей прямой и обратной реакций идеального обмена.
Последняя особенность не накладывает никаких ограничений на численные значения этих констант.
Рассмотрим простую реакцию идеального изотопного обмена между молекулами АХ и ВХ* (IV), происходящую в гомогенной системе при постоянных давлении и температуре.
В начальный момент времени (t=0) в системе
присутствуют три разновидности молекул: АХ, ВХ и ВХ*, различающиеся
по химической природе или изотопному составу. В результате обмена в системе
появляется еще одна разновидность—АХ*, после чего обмен изотопными
атомами элемента Х будет происходить между всеми разновидностями молекул АХ и
ВХ. Наше рассмотрение мы будем проводить применительно к обмену радиоактивного
изотопа. В этом случае форма ВХ* содержит ничтожное коли чество X*.
При этом можно выделить две группы процессов:*
1) обмен различными изотопами неодинаковых молекул
|
1. AX* + BX |
w1 |
|
2. AX + BX* |
w2 |
2) обмен одинаковыми атомами неодинаковых молекул
|
3. AX* + BX*
|
w3 |
|
4. AX + BX |
w4 |
Как указывалось выше, одной из особенностей реакций идеального изотопного обмена является постоянство общей скорости обмена атомами элемента Х между молекулами АХ и ВХ. Это относится также к суммарной скорости интересующих нас процессов первой и второй групп, хотя вклад в нее отдельных составляющих, соответствующих различным процессам, изменяется
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.