
![]() 4s eg*
4s eg*


![]()
![]()
![]()
![]() 3d
3d
![]()
![]()
![]()
![]()
![]()
![]() t2g
t2g ![]()
![]()
![]()
![]()
![]()
![]()
![]()


![]()
![]() 10Dq
10Dq
eg
![]()
![]()
t1u ![]()
![]()
![]()
![]() a1g
a1g
свободный ион комплекс лиганды
металла
Рис.12.8. Схема связей в октаэдрическом комплексе [Ti(H2O)6]3+.
Вычислить величину расщепления D по ТПЛ ещё сложнее, чем по ТКП. В то же время представления о высокоспиновых и низкоспиновых комплексах здесь сохраняются. Если орбитали лигандов лежат энергетически много ниже орбиталей атома металла, тогда орбитали t2g и eg, вычисленные по ТПЛ, весьма близки по своим значениям к вычисленным по ТКП.
12.6.1. Октаэдрические гибридные орбитали Полинга.
Интересно сравнить теорию поля лигандов для октаэдрического комплекса с теорией гибридизации Полинга. Например, для комплекса [Fe(CN)6]3- по теории Полинга в гибридизации d2sp3 участвуют следующие орбитали: dz2, dx2-y2, s, px, py, pz. В результате смешения образуются 6 гибридных октаэдрических орбиталей, которые образуют s-связи с орбиталями лигандов. Если бы эти связи были чисто ковалентными, комплекс имел бы строение Fe3-(CN)6; если бы чисто ионным, то - Fe3+(CN-)6. Т.к. группа CN- более электроотрицательна, чем центральный ион, то второй вариант ближе к истине.
12.6.2. p-связь с лигандами.
При образовании координационного соединения между центральным атомом и лигандами возникают не только s-связи, но и p-связи. На рис.12.9 представлена схема образования p-связей в плоских квадратных комплексах. В образовании связей участвуют волновые функции dxy (центрального атома), px и py (лигандов).
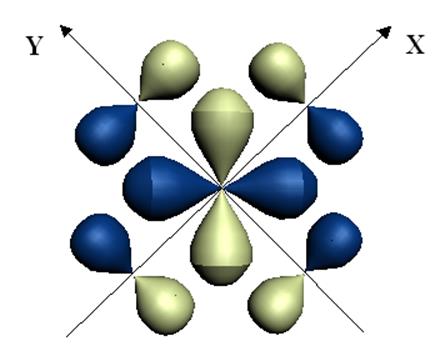
Рис.12.9. Схема образования p-связей в плоском квадратном комплексе.
12.6.3. Экспериментальное доказательство делокализации электронов.
Теория поля лигандов предсказывает делокализацию электронов. Электроны, частично заполненных подслоёв eg и t2g, делокализуются в направлении от атома металла к лигандам. С помощью современных физических методов удалось подтвердить делокализацию электронов. Так окружение электрона заметно сказывается на его g-факторе (отношение полного механического к полному магнитному моменту). С помощью ЭПР измерений определяют g-фактор и из этих данных получают сведения о распределении парамагнитных электронов.
Свидетельство о делокализации электронов можно получить и из анализа сверхтонкой структуры оптических спектров. Например, если электрон лиганда Cl- находится на нём не всё время (делокализуется), то взаимодействие возникающей дырки со спином ядра хлора приведёт к появлению сверхтонкой структуры уровней, наложенной на основную сверхтонкую структуру центрального атома.
Обратное явление - отход парамагнитного электрона от центрального атома к лигандам – также сказывается на виде сверхтонкой структуры. Ослабление взаимодействия электрона с центральным атомом приводит к сокращению интервалов между линиями СТС (сверхтонкой структуры).
12.6.4. Карбонилы металлов.
Доказательством общности ТПЛ и особой роли неспаренных электронов в образовании координационных соединений является хорошее по результатам описание с помощью этой теории комплексов, в которых в качестве лигандов выступает карбонильная группа СО, которая не имеет заряда и не является диполем. В соответствии с ТПЛ в октаэдрическом карбониле Cr(CO)6 двенадцать электронов шести молекул СО переходят на s-связывающие орбитали комплекса (a1g, eg, t1u). Шесть электронов хрома располагаются на - t2g-орбиталях. Эти орбитали не участвуют в образовании s-связей. Но они могут образовать d-p-связи со свободными разрыхляющими p-орбиталями молекулы СО: каждая из трёх t2g-орбиталей с p*-орбиталями двух молекул СО (см. рис.12.10).
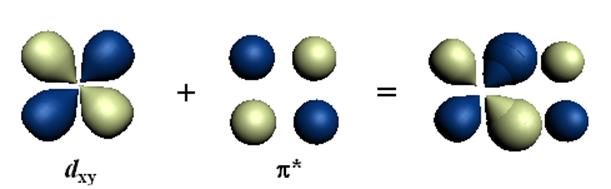
Рис.12.10. Образование d-p-связи в карбониле переходного металла.
Итак, в карбониле Cr(CO)6, как и в других карбонилах, связь возникает, в основном, за счёт обобществления в комплексе электронов неподелённых пар молекул СО и внешних электронов атома металла. Несомненно, что объяснение связей в карбонилах металлов и им подобных соединениях является большим успехом ТПЛ (метода МО ЛКАО).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.