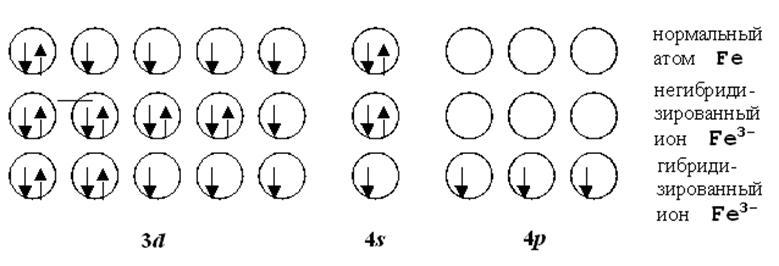
Рис.12.2. Гибридизация АО в ионе Fe3-.
Образование комплекса [Fe(CN)6]3- происходит постадийно как представлено на рис.12.2. Октаэдрически гибридизированная атомная орбиталь железа спаривается со свободной орбиталью одной из групп CN-. У иона CN- имеется свободная разрыхляющая p-орбиталь [КК(zs)2(ys)2(xs)2(wp)4(vp)0]. Чаще всего гибридные орбитали строятся из орбиталей (n - 1)d, ns и np (при n = 4; для Fe, Co, Ni). Однако иногда для гибридизации приходится выбирать и орбитали с одинаковым главным квантовым числом. Например, в случае молекулы SF6 посредством двухкратного возбуждения электронная конфигурация переходит из (3s)2(3p)4 в (3s)(3p)3(3d)2. Основанием для такого предположения служит то, что элементы 3-го периода образуют такие соединения ((SiF6)2-, (PF6)-), а элементы 2-го периода - нет.
Согласно Полингу атомные орбитали могут смешиваться и в соотношении sp2d, давая 4 эквивалентные гибридные АО, расположенные в одной плоскости с валентными углами в 900. Такая квадратная или тетрагональная гибридизация описывается следующей волновой функцией:
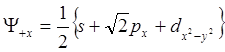 . (12.6)
. (12.6)
Сила таких орбиталей по Полингу 2.693. Плоскую квадратичную форму имеют комплексы: [Ni(CN)4]2-,[PtCl4]2-. В таблице 12.1 представлены данные по важнейшим типам гибридизации и силе их АО.
Таблица 12.1. Важнейшие типы гибридизации и силы АО по Полингу и Шерману.
|
АО |
вид гибридной орбитали |
координацион-ное число |
сила орбитали |
|
s p
|
не смешанная орбиталь |
1 1.732 1.936 2.236 |
|
|
sp, dp |
линейная (диагональная) |
2 |
1.933 |
|
sp2,dp2,d2s d2p |
тригональная плоская тригональная пирамидальная |
3 |
1.991 |
|
sp3,d3s dsp2 |
тетраэдрическая тетрагональная плоская |
4 |
2.000 2.693 |
|
dsp3, d3sp d4s |
бипирамидальная тетрагональная пирамидальная |
5 |
|
|
d2sp3 d4sp |
октаэдрическая тригональная призматическая |
6 |
2.924 |
12.3. Расщепление уровней в кристаллическом поле (электростатическое расщепление).
Расщепление уровней центрального атома и заполнение их электронами рассмотрим с позиций теории кристаллического поля (ТКП). В ТКП лиганды моделируются точечными отрицательными зарядами. Орбитали же центрального атома представляются в явном виде. Предполагается, что спектральные, магнитные и другие характеристики комплексов переходных металлов полностью определяются соотношением энергий гибридизированных АО, получающихся из исходных s-, p-, d- или f- орбиталей центрального атома, под влиянием кристаллического (электрического) поля точечных зарядов (лигандов), и тем, как эти орбитали заполнены электронами. В изолированном атоме все пять d-орбиталей пятикратно вырождены, т.е. им соответствует одна и та же энергия. При окружении атома лигандами вырождение снимается (эффект Штарка). Впервые подобное расщепление, а именно, расщепление уровней разной симметрии в кристалле NaCl исследовали Бете (1929) и Ван-Флек (1932 г.). Отсюда и название метода, используемого для комплексных соединений, – теория кристаллического поля. Следует отметить, что в отличие от других электростатических теорий химической связи здесь центральный ион рассматривается не просто как заряженная частица. Строение его внешней электронной оболочки детализируется на основе квантовой механики. Например, для комплексов АХ4(PtF4) наблюдаемая конфигурация плоского квадрата уже не может быть объяснена простыми электростатическими соображениями.
Глубокое исследование затронутой нами проблемы возможно только с использованием теории групп, что выходит за рамки нашего курса. Мы рассмотри только основные представления теории кристаллического поля.
12.3.1. Плоский квадратный комплекс.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.