12.5. Сильные и слабые поля. Максимальный и минимальный спины.
Рассмотрим
возможные схемы заполнения d-атомных орбиталей, например, в поле
октаэдрической симметрии. При этом возможны два варианта. В случае, если
величина расщепления D невелика, т.е. поле слабое, то сперва
три электрона с параллельными спинами заполняют нижний уровень. Затем два
электрона с параллельными спинами заполняют верхний уровень. Этот высокоспиновый
вариант имеет суммарный спин 5/2 (5 электронов). Если значение D значительно (сильное поле), то заполнение верхнего
уровня энергетически невыгодно. В этом случае максимальный спин 3/2 (3
электрона). Это низкоспиновый вариант. За границу между “слабым”
и “сильным” полем лигандов принимают величину расщепления 20000 см-1 (2.48
эВ). Эмпирически установлено, что многие типичные лиганды можно расположить в
ряд по возрастающим значениям D. Природа центрального атома не
значительно, но всё же влияет на величину расщепления. Величина D (иногда её обозначают как 10Dq) растёт в ряду
(спектрохимический ряд): I- < Br- < Cl- < SCN- < F- < OH- < C2O42- » H2O < NH2CH2COO- < NH3 < C2H5NH2 < этилендиамид » SO32- < NH2OH < NO2- < CN-. Частота максимума оптического поглощения вычисляется
по формуле: 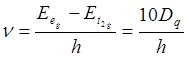 . Величины расщеплений
представлены в табл. 12.2. Если рассмотреть все возможные варианты заполнения
атомных орбиталей (см. табл.12.3), то можно видеть, что высокоспиновые и
низкоспиновые варианты различаются только в интервале чисел d-электронов
4 ¸ 7.
. Величины расщеплений
представлены в табл. 12.2. Если рассмотреть все возможные варианты заполнения
атомных орбиталей (см. табл.12.3), то можно видеть, что высокоспиновые и
низкоспиновые варианты различаются только в интервале чисел d-электронов
4 ¸ 7.
Таблица 12.2 Величины расщеплений для слабых и сильных лиганд.
|
электронное состояние |
лиганды |
расщепление D |
||
|
волн. число, см-1 |
энергия, эВ |
длина волны, нм |
||
|
3d |
Слабые сильные |
10000 30000 |
1.2 3.7 |
1000 333 |
|
4d |
слабые сильные |
14000 42000 |
1.7 5.0 |
714 238 |
|
5d |
слабые сильные |
18000 54000 |
2.2 6.7 |
555 185 |
Например, ион Fe3+ в отсутствии поля лигандов имеет S = 5/2 и все 5 d-орбиталей вырождены. Тот же ион железа в слабом поле лиганд F- ([FeF6]3-) даёт высокоспиновый комплекс с S = 5/2, а в сильном поле лиганд CN- ([Fe(CN)6]3-) образует низкоспиновый комплекс с S = 1/2.
В таблице 12.3 представлены суммарный спин и энергия стабилизации кристаллического поля (ЭСКП) для ряда ионов d-элементов.
Таблица 12.3 Число неспаренных электронов n, суммарный спин S и ЭСКП (относительные единицы) для ионов некоторых d-элементов при октаэдрической конфигурации комплекса.
|
число d-электронов |
ионы d-элементов |
слабое поле |
сильное поле |
||||
|
n |
S |
ЭСКП |
n |
S |
ЭСКП |
||
|
dO |
Ca2+, Sc3+ |
0 |
0 |
0 |
0 |
0 |
0 |
|
d1 |
Ti3+ V4+ |
1 |
1/2 |
4 |
1 |
1/2 |
4 |
|
d2 |
Ti2+ V3+ |
2 |
1 |
8 |
2 |
1 |
8 |
|
d3 |
V2+ Cr3+ |
3 |
3/2 |
12 |
3 |
3/2 |
12 |
|
d4 |
Cr2+ Mn3+ |
4 |
2 |
6 |
2 |
1 |
16 |
|
d5 |
Mn2+ Fe3+ Os3+ |
5 |
5/2 |
0 |
1 |
1/2 |
20 |
|
d6 |
Fe2+ Co3+ Ir3+ |
4 |
2 |
4 |
0 |
0 |
24 |
|
d7 |
Co2+ Ni3+ Rh2+ |
3 |
3/2 |
8 |
1 |
1/2 |
18 |
|
d8 |
Ni2+ Au3+ Pt2+ |
2 |
1 |
12 |
2 |
1 |
12 |
|
d9 |
Cu2+ Au2+ |
1 |
1/2 |
6 |
1 |
1/2 |
6 |
|
d10 |
Cu+ Zn2+ Ag+ Cd2+ |
0 |
0 |
0 |
0 |
0 |
0 |
В чисто электрическом кристаллическом поле имеют место ещё два эффекта: спин-орбитальное взаимодействие и эффект Яна-Теллера.
Спин-орбитальное взаимодействие - это взаимодействие спинового магнитного момента электрона с его орбитальным магнитным моментом. Так в случае октаэдрического комплекса [Ti(H2O)6]3+, когда у центрального иона всего один валентный электрон, вырождение уровня t2g снимается именно из-за спин-орбитального взаимодействия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.