0.987p + 0.064s + 0.15d, (10.12)
что даёт следующие веса: 3р - 0.974, 3s - 0.004 и 3d - 0.022. Связь сохраняет р-характер, но небольшая примесь d-состояния уменьшает напряжение.
10.8. Дипольные моменты. Атомный диполь.
Отличительной особенностью гибридных АО по отношению к
составляющим их компонентам s-, p- ... орбиталей является
отсутствие центра симметрии. Центр тяжести находится на каком-то расстоянии ![]() от ядра. Для орбитали
от ядра. Для орбитали
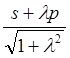 (10.13)
(10.13)
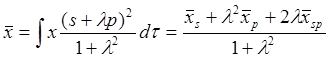 .
(10.14)
.
(10.14)
Величины
![]() s и
s и ![]() р
(средние значения координат для АО s- и рx-типа) равны
нулю.
р
(средние значения координат для АО s- и рx-типа) равны
нулю.
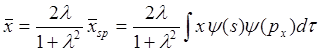 (10.15)
(10.15)
Для чистых s- и p-состояний при l = 0 или ¥ ![]() ® 0. Однако для гибридов
® 0. Однако для гибридов ![]() может быть велико. Так
для диагональной sp-гибридной АО при l = 1 для атома
углерода
может быть велико. Так
для диагональной sp-гибридной АО при l = 1 для атома
углерода ![]() = 0.89 rо. Такая
асимметрия заряда, возникающая при подготовке атома углерода к образованию
связи, позволяет ввести понятие атомного диполя:
= 0.89 rо. Такая
асимметрия заряда, возникающая при подготовке атома углерода к образованию
связи, позволяет ввести понятие атомного диполя:
![]() .
(10.16)
.
(10.16)
В случае углерода вклад каждого электрона в атомный дипольный момент может достигать 2.2 D. В молекуле метана четыре связи дают результирующий момент равный нулю, но дипольный момент пары электронов, ответственных за каждую связь С-Н, отличен от нуля. При этом водород приобретает отрицательный, а углерод положительный заряды. Этот вывод находится в противоречии со значениями электроотрицательностей атомов углерода и водорода (хС = 2.5 и хН = 2.1). В действительности непосредственно доступно измерение лишь полного дипольного момента молекулы. Разделение полного момента на составляющие производится для удобства анализа и детального описания свойств молекулы. Независимо от метода расчёта (по методу валентных связей или молекулярных орбиталей) в случаях, когда связь является результатом полного спаривания двух АО соседних атомов, эти АО почти всегда будут гибридными. Степень гибридизации такова, что каждая отдельная связь лишь слегка полярна. Результирующий дипольный момент молекулы почти полностью обусловлен неподелёнными электронами.
10.9. Структура СО и СО2.
Рассмотрим структуру связи молекулы СО. Какова кратность связи? Почему мал дипольный момент (0.1 D). Почему полярность молекулы С- О+? Хотя электроотрицательность кислорода (хО = 3.5) больше, чем углерода (хС = 2.5). Но начнём с молекулы СО2. Известно, что эта молекула линейна. Атомные орбитали валентных электронов углерода должны быть гибридизированы приблизительно как в молекуле ацетилена. Гибридные АО образуются из 2s- и 2р-состояний (s ± px). Эти АО перекрываются с 2рх АО атома кислорода (возможно, содержащими небольшую примесь 2s-состояния) с образованием двух локализованных s-связей. После этого у атома углерода остаются два р-электрона (рy и рz), а у атомов кислорода по два электрона на заполненных 2s-оболочках и по три на рy- или рz-оболочках. Неспаренные электроны дают по одной p-связи на каждый атом кислорода. При этом рy-электрон углерода спаривается с рy-электроном одного атома кислорода, а рz-электрон углерода с рz-электроном другого атома кислорода. Естественно, электроны рy и рz можно поменять местами.
Переходя к молекуле СО следует отметить, что длины связи С-О в молекулах СО и СО2 практически одинаковы. Кроме того, результирующий заряд на кислороде в обоих случаях одинаков. Основываясь на сказанном выше, про молекулу СО можно сказать следующее:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.