![]() (10.4)
(10.4)
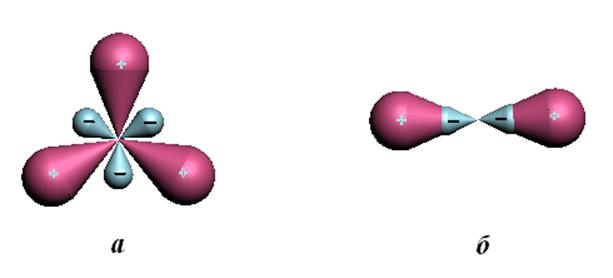
Рис.10.3. Тригональная (а) sp2- и диагональная (б) sp-гибридные АО.
Тригональная
гибридизация используется для описания этиленподобных состояний. В этилене (Н2С=СН2) все 6 атомов лежат в одной плоскости и углы несильно
отличаются от 120о. Из трёх тригональных орбиталей одного атома
углерода одна перекрывается с себе подобной от другого атома углерода с
образованием s-связи, а две другие образуют s-связь с двумя атомами водорода. Вторая связь между атомами углерода
образуется за счёт перекрывания оставшихся р-орбиталей с образованием p-связи. Такая двойная связь требует плоской структуры молекулы этилена,
малого расстояния между атомами углерода (1.34 ![]() вместо
1.54
вместо
1.54 ![]() для простой С-С-связи) и большой энергии для скручивания молекулы (в
обычном состоянии вращение вообще отсутствует).
для простой С-С-связи) и большой энергии для скручивания молекулы (в
обычном состоянии вращение вообще отсутствует).
В молекуле ацетилена НСºСН тройная связь образуется за счёт диагональной гибридной и двух р-орбиталей от каждого атома углерода. Т.о. в этом случае тройная связь состоит из одной s-связи и двух p-связей. Соответственно молекула ацетилена линейна и характеризуется осевой симметрией.
10.3. Не эквивалентные гибридные АО.
Рассмотренные три типа гибридизации sp3, sp2 и sp дают эквивалентные атомные орбитали. Однако возможно образование промежуточных видов гибридных АО, которые не все будут между собой эквивалентными. Необходимым условием существования любых гибридных АО является их ортогональность. В противном случае каждая из орбиталей будет включать в себя часть от всех прочих. Условие ортогональности: 1 + lm cosQij = 0. Выведем условие ортогональности для гибридных АО. Любая гибридная орбиталь, построенная из s- и р-орбиталей и имеющая максимум в направлении i, может быть выражена так:
s + lpi, (10.5)
где l - коэффициент смешивания. Тогда в направлении j
s + mpj. (10.6)
Эти две гибридные АО будут ортогональны, если выполняется условие:
![]() .
(10.7)
.
(10.7)
Т.к.
![]() , то
, то
![]() .
.
Из
условия нормиронованности и ортогональности АО s, pi и pj следует,
что ![]() ,
, ![]() и
и ![]() . Учитывая, что
. Учитывая, что ![]() ,
получаем условие ортогональности:
,
получаем условие ортогональности:
1 + lmcosQij = 0. (10.8)
Таблица 10.1. Эквивалентные гибридные АО (коэффициенты в выражении N(s + lp)).
Гибридизация |
sp |
sp2 |
sp3 |
|
соединение |
ацетилен |
этилен |
метан |
|
валентный угол Q |
180О |
120О |
109О28¢ |
|
cosQ |
- 1 |
- |
- |
|
N |
1 |
|
|
|
l |
|
|
|
Теперь можно составить гибридные орбитали, подобные 10.5, для любых четырёх направлений (в тетраэдре), если найдены соответствующие коэффициенты l, m, ..., удовлетворяющие условию 10.8. Если гибридные орбитали эквивалентны, то 1 + l2cosQij = 0. В табл.10.1 представлены данные по эквивалентным гибридным АО. Очевидно, что cosQij должен быть отрицательным, откуда Qij ³ 900. Это справедливо и когда гибридные АО неэквивалентны. Рассмотренные типы гибридизации справедливы не только для углерода, но по отношению и к другим атомам, имеющих s- и р-электроны приблизительно одинаковой энергии.
10.4. Валентное состояние.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.