Автокатализом называется явление, когда каталитическое действие на реакцию оказывает какой-либо из ее продуктов. Для автокаталитической реакции характерно, что процесс идет при возрастающей концентрации катализатора. Поэтому скорость автокаталитической реакции в начале реакции возрастает и лишь на более глубоких стадиях начинает падать в результате убыли концентрации исходных веществ. Кинетическая кривая для продукта автокаталитической реакции имеет S-образный вид (рис. 1) подобно кинетической кривой продукта двух последовательных реакций.
Реакция может развиться по автокаталитическому пути в двух случаях: 1) если наряду с автокаталитическим превращением исходного вещества А в продукт реакции В возможно некаталитическое превращение А в В; 2) если в начальный момент в системе присутствует некоторое незначительное количество продукта реакции (начальная затравка).
В простейшем случае автокаталитической реакции первого порядка по А и В скорость образования продукта превращения равна
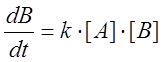 .
.
Обозначая через x прирост [B] в результате реакции, т. е. полагая x = [B] – B0, и учитывая, что прирост [B] равен убыли [A], можно получить следующее выражение:
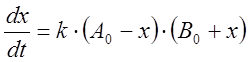 .
(8)
.
(8)
Уравнение такого же вида получается в случае, если никакой затравки в систему не вносится, но параллельно с автокаталитическим превращением идет некаталитическое превращение А в В по реакции первого порядка. В этом случае
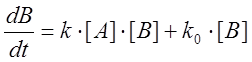 ,
,
откуда
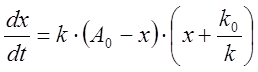 .
.
Это выражение формально совпадает с (8), только вместо В0 в нем стоит k0/k. Интегрирование уравнения (8) дает
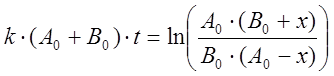
или в виде, разрешенном относительно х,
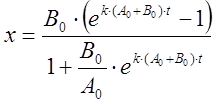 .
(9)
.
(9)
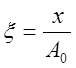 ,
, 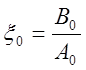 , то уравнение (9) примет вид
, то уравнение (9) примет вид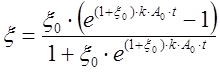 .
(10)
.
(10)
Если экспериментально получена кинетическая кривая автокаталитической реакции, следующей уравнению (8), то для вычисления константы скорости k можно воспользоваться уравнениями (9–10).
Проще всего эти параметры находятся, если В0 << A0. В этом случае соотношение (10) можно записать в виде
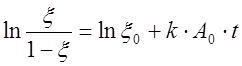 .
(11)
.
(11)
Построив графически зависимость 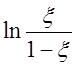 от t, по
наклону полученной прямой линии можно определить k×A0 и, следовательно, k.
от t, по
наклону полученной прямой линии можно определить k×A0 и, следовательно, k.
В случае, когда
реакция проводится без начальной затравки катализатора, то при наличии
медленной стадии некаталитического превращения А в В, величина x0
будет определяться константой скорости этой стадии: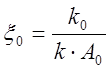 .
.
Таким образом, определив k по наклону прямой и x0 по величине отрезка, отсекаемого ею на оси ординат, можно вычислить значение k0.
Примером
автокаталитической реакции может служить окисление щавелевой кислоты
перманганатом калия. Эта реакция протекает по сложному механизму, лимитирующей
стадией которого является взаимодействие ![]() с ионом
с ионом
![]() :
:
![]() .
(12)
.
(12)
Образовавшийся ион ![]() далее
окисляет щавелевую кислоту с образованием
далее
окисляет щавелевую кислоту с образованием ![]() и
и ![]() :
:
![]()
(последний процесс, по-видимому, является двустадийным).
Учитывая тот факт,
что помимо ![]() в реакции образуется
в реакции образуется ![]() , в системе протекает диспропорционирование
, в системе протекает диспропорционирование ![]() :
:
![]()
Таким образом, можно записать вероятную брутто-реакцию:
![]() .
.
Скорость реакции
равна скорости лимитирующей стадии (12) и пропорциональна произведению
концентраций одного из исходных веществ (![]() ) на
концентрацию одного из продуктов (
) на
концентрацию одного из продуктов (![]() ). Поэтому скорость
реакции описывается уравнением, подобным уравнению (8):
). Поэтому скорость
реакции описывается уравнением, подобным уравнению (8):
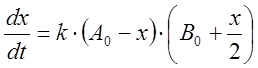 ,
,
интегрирование которого даст выражения, аналогичные (9–11):
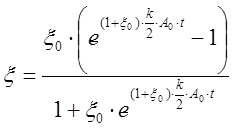 ;
(13)
;
(13)
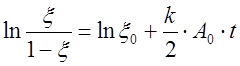 ,
(14)
,
(14)
где 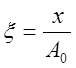 ,
, 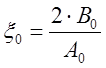 .
.
В отсутствие
начальной затравки ![]() реакция протекает со
значительным временем индукции (при 25 оС и при концентрациях
реагентов, используемых в данной работе, это время составляет ~ 30 мин). По
всей вероятности, это обусловлено протеканием медленной некаталитической
реакции окисления щавелевой кислоты с образованием
реакция протекает со
значительным временем индукции (при 25 оС и при концентрациях
реагентов, используемых в данной работе, это время составляет ~ 30 мин). По
всей вероятности, это обусловлено протеканием медленной некаталитической
реакции окисления щавелевой кислоты с образованием ![]() .
.
При использовании
исходной затравки ![]() время индукции существенно
уменьшается.
время индукции существенно
уменьшается.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.