![]() Авторы [18]
нашли, что скорость триггерных волн пропорциональна ([H+][BrO3–])1/2
и не зависит от концентраций других компонентов реакционной смеси. Это
возможно, если стадия автокатализа лимитирована процессом
Авторы [18]
нашли, что скорость триггерных волн пропорциональна ([H+][BrO3–])1/2
и не зависит от концентраций других компонентов реакционной смеси. Это
возможно, если стадия автокатализа лимитирована процессом
HBrO2 + BrO3– + H+ ¾® 2 BrO2· + H2O.
Тогда скорость распространения автокаталитической волны в реакции Белоусова–Жаботинского подчиняется выражению [5]:
![]() . (11)
. (11)
Высокая концентрация бромид-иона непосредственно перед волновым фронтом приводит к тому, что стадия
![]() Br– + HBrO2 +H+
2 HOBr
Br– + HBrO2 +H+
2 HOBr
также влияет на скорость волны. При этом более точное выраже-ние для скорости имеет вид
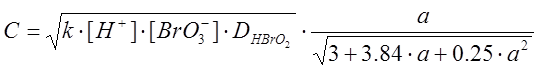 , (12)
, (12)
где
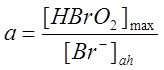 ,
, ![]() –
концентрация бромид-иона перед фронтом [5].
–
концентрация бромид-иона перед фронтом [5].
Химические волны в реакционной среде БЖ распространяются вследствие диффузии HBrO2 впереди волнового фронта, что приводит к возбуждению следующего элемента объема. Волны БЖ движутся из области высокой концентрации HBrO2 и низкой концентрации Br– в область высокой концентрации Br– и низкой концентрации HBrO2. В средней части волны происходит окисление катализатора и разложение HBrO2. На пологом заднем фоне происходит медленное восстановление окисленного катализатора M(n+1)+ и уменьшение концентрации Br– до исходной величины [5].
Бегущие химические волны наблюдали также в системе иодат–мышьяковистая кислота [22–24]. Система иодат–мышьяковистая кислота может быть представлена совокупностью реакций окисления иодида иодатом (А) и восстановления иода мышьяковистой кислотой (В) [25 – 27]:
IO3– + 5 I– + 6 H+ = 3 I2 + 3 H2O; (A)
H3AsO3 + I2 + H2O = H3AsO4 + 2 I– + 2 H+. (B)
Глэнсдорф и Пригожин [28] теоретически показали, что для возникновения колебаний концентраций реагентов, интермедиатов и продуктов, множественности стационарных состояний, распространяющихся волн высокой или низкой концентрации интермедиатов необходимо, чтобы система находилась вдали от состояния термодинамического равновесия. К возникновению неустойчивостей в химических реакциях могут вести автокатализ, перекрестный катализ, ингибирование, субстратное ингибирование и т. д. [5].
Экспериментальная часть
Целью данной лабораторной работы является ознакомление с колебаниями в химических системах, а также математический расчет кинетических параметров упрощенной схемы механизма реакции, описывающей колебания. В качестве реагентов используется бромат калия, малоновая кислота и сернокислый церий. Реакция проводится в кислой среде.
Исходные реактивы: 3N H2SO4, 5·10–3 M Ce(SO4)2 в 3N H2SO4, KBrO3 или NaBrO3 (кристаллический), малоновая кислота СО2НСН2СО2Н (кристаллическая); 1М KBr (в капельнице), 1M AgNO3 (в капельнице).
1. Исследование различных режимов колебаний
Приготовить из исходным веществ три раствора со следующими концентрациями реагентов:
|
Параметр |
Раствор 1 |
Раствор 2 |
Раствор 3 |
|
[Сe(SO4)2]0, M |
10–3 |
10–3 |
10–3 |
|
[BrO3–]0, M |
6·10–2 |
6·10–2 |
6·10–2 |
|
[CH2(COOH)2]0, M |
6·10–2 |
0.3 |
1.2 |
|
[H2SO4]0, M |
1.5 |
1.5 |
1.5 |
|
a= [BrO3–]0/[CH2(COOH)2]0 |
1 |
0.2 |
0.05 |
|
Режим колебаний |
Релакса-ционный |
Переход-ный |
Квазигармони-ческий |
Приготовив раствор, быстро перемешать его стеклянной палочкой и записать изменение оптической плотности от времени на длине волны l = 380 нм или l = 420 нм. Использовать для этих целей кюветы с длиной оптического пути 1–3 см.
На основе механизма реакции БЖ и кинетических данных объяснить форму наблюдаемых колебаний. Проследить за изменением формы колебаний при уменьшении параметра a и объяснить это изменение.
2. Исследование влияния примесей на поведение колебаний
В области релаксационного или переходного режима, когда начнется фаза нарастания Ce4+, ввести прямо в кювету ионы Br– (несколько капель 1М раствора KBr), а в фазе спада ввести ионы Ag+ (две капли 1М раствора AgNO3).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.