
























1.1. Основные понятия
Химическая кинетика - это наука о скоростях и механизмах химических превращений. Вещества, принимающие участие в химическом превращении, подразделяются на исходные, промежуточные и конечные вещества. Такое разделение условно. В действительности все химические реакции обратимы. Конечным состоянием химической системы является состояние равновесия, в котором присутствуют как конечные продукты, так и исходные и промежуточные вещества (хотя бы в малых количествах).
1.2. Стехиометрическое уравнение реакции
Пусть в реакцию вступают ![]() молекул типа
молекул типа ![]() ,
, ![]() молекул
типа
молекул
типа ![]() , … ,
, … , ![]() молекул
типа
молекул
типа ![]() , и при этом продуктами реакции являются
, и при этом продуктами реакции являются ![]() молекул типа
молекул типа ![]() ,
,![]() молекул типа
молекул типа ![]() , … ,
, … , ![]() молекул типа
молекул типа ![]() :
:
![]() (1.1)
(1.1)
Выражение (1.1)
называется стехиометрическим уравнением реакции, а числа ![]() и
и ![]() -
стехиометрическими коэффициентами.
-
стехиометрическими коэффициентами.
1.3. Простые (элементарные) и сложные химические процессы, механизм реакции
Реакция, описывающаяся стехиометрическим уравнением (1.1), называется простой
(элементарной), если она протекает в одну стадию, т.е.
при одновременном взаимодействии ![]() молекул. В этом случае
стехиометрическое уравнение реакции уже является однозначным. Его следует
записывать так, как протекает химическая реакция.
молекул. В этом случае
стехиометрическое уравнение реакции уже является однозначным. Его следует
записывать так, как протекает химическая реакция.
Реакция, протекающая в несколько стадий, называется сложной. Совокупность элементарных стадий сложной химической реакции называется ее механизмом. Стехиометрическое уравнение сложной химической реакции стараются записать так, чтобы стехиометрические коэффициенты были по возможности целочисленными и небольшой величины.
1.4. Гомогенные и гетерогенные реакции
Химическая реакция называется гомогенной, если все ее стадии протекают в пределах одной фазы. Реакция называется гетерогенной, если хотя бы одна ее стадия протекает на поверхности раздела фаз (например, каталитические реакции).
1.5. Замкнутые и открытые системы
В замкнутых системах отсутствует материальный обмен с окружающей средой. Система называется открытой, если возможен обмен с окружающей средой.
1.6. Скорость химической реакции
Скорость реакции характеризует скорость изменения концентраций реагирующих веществ и продуктов реакции во времени. Если реакция представлена стехиометрическим уравнением (1.1), то скорость реакции определяется следующим образом:
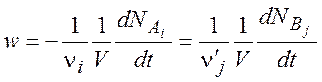 (1.2)
(1.2)
При постоянном объеме (V = const) скорость можно выразить через концентрации:
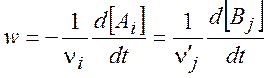 (1.3)
(1.3)
Для элементарной реакции скорость реакции можно определить как число элементарных актов реакции, происходящих в единице объема в единицу времени. Для сложных химических реакций, описываемых стехиометрическим уравнением типа (1.1) может быть введено понятие единой скорости процесса то формуле (1.2) только тогда, когда концентрации промежуточных веществ пренебрежимо малы по сравнению с концентрациями реагентов и продуктов реакции. В противном случае понятие единой скорости введено быть не может и нужно рассматривать скорость реакции по конкретному веществу.
1.7. Закон действующих масс
Для элементарной реакции, описываемой стехиометрическим уравнением (1.1), скорость реакции зависит от концентраций реагентов следующим образом (закон действующих масс):
![]() (1.4)
(1.4)
где коэффициент пропорциональности k
не зависит от концентраций реагентов, а зависит только от температуры, ![]() . Этот коэффициент называется константой
скорости реакции (1.1). Величина
. Этот коэффициент называется константой
скорости реакции (1.1). Величина ![]() называется порядком
реакции по
называется порядком
реакции по ![]() -му реагенту, а
-му реагенту, а ![]() -
полным порядком реакции.
-
полным порядком реакции.
1.8. Температурная зависимость константы скорости
Аррениус предложил следующую эмпирическую формулу для температурной зависимости константы скорости (1889 г.):
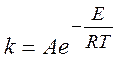 (1.5)
(1.5)
где E – энергия активации реакции, A – предэкспонент.
1.9. Аррениусовские координаты
Зависимость константы скорости от
температуры (1.5) спрямляется в координатах ![]() и
и ![]() (Аррениусовские координаты)
:
(Аррениусовские координаты)
:
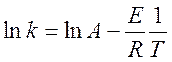 (1.6)
(1.6)
1.10. Закон действующих масс с учетом микроскопических состояний
В случае, если нас интересует скорость расходования и образования частиц в определенных квантовых состояниях, можно обобщить закон действующих масс. Стехиометрическое уравнение реакции с учетом микроскопических состояний:
![]() (1.7)
(1.7)
Скорость этого процесса:
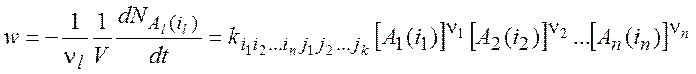 (1.8)
(1.8)
1.11. Тепловой эффект реакции. Эндоэргические, экзоэргические, Эндотермические и экзотермические реакции
В ходе экзотермической реакции выделяется тепло. В ходе эндотермической реакции тепло поглощается. С другой стороны, если энергетический уровень основного состояния продуктов лежит ниже уровня основного состояния исходных веществ, реакция называется экзоэргической, в обратном случае – эндоэргической.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.