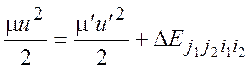 (2.24)
(2.24)
![]() (изменение внутренней энергии
сталкивающихся молекул)
(изменение внутренней энергии
сталкивающихся молекул)
Выражение (2.23) справедливо, если внутренние состояния молекул невырожденные. В случае вырожденных состояний справедлива формула
![]()
![]() (2.25)
(2.25)
где ![]() ,
, ![]() ,
, ![]() ,
, ![]() - степени вырождения состояний реагентов и
продуктов.
- степени вырождения состояний реагентов и
продуктов.
В случае максвелловского распределения по скоростям:
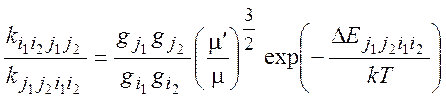 (2.26)
(2.26)
Аналогичным образом могут быть получены соотношения между константами скорости прямого и обратного процессов при любой степени их детализации (при условии равновесного распределения по всем остальным степеням свободы).
Глава 3. Формальная кинетика сложных реакций
3.1. Последовательные и параллельные реакции
Две реакции называются последовательными, если продукт первой реакции является исходным веществом для второй. Например,
![]()
Реакции называются параллельными, если в каждой из них принимает участие хотя бы одно общее исходное вещество. Например,
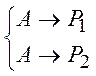
Параллельно-последовательными называются реакции, параллельные по одному веществу и последовательные по другому:
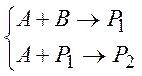
Для описания кинетики сложных реакций используется закон действующих масс для каждой элементарной стадии и принцип независимости элементарных стадий.
Принцип независимости элементарных стадий состоит в том, что скорость образования или расходования какого-либо вещества может быть представлена в виде суммы вкладов от различных элементарных реакций, т.е. протекание одной элементарной реакции не влияет на протекание другой.
Рассмотрим пример – цепь необратимых последовательных реакций первого порядка
![]() (3.1)
(3.1)
Закон действующих масс и принцип независимости элементарных стадий приводит к системе дифференциальных уравнений первого порядка:
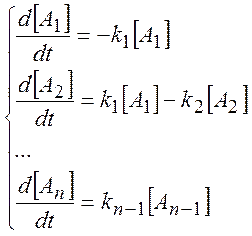 (3.2)
(3.2)
или в матричном виде
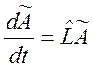 (3.3)
(3.3)
Эта система линейных дифференциальных уравнений интегрируется стандартным методом. Из характеристического уравнения
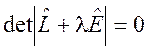 (3.4)
(3.4)
находятся собственные значения ![]() ,
,
![]() , … ,
, … , ![]() , и
решение может быть представлено (для простоты собственные значения
, и
решение может быть представлено (для простоты собственные значения ![]() считаются различными) в виде
считаются различными) в виде
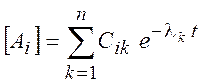 ,
, 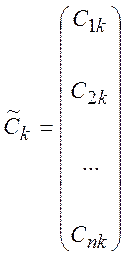 (3.4)
(3.4)
где ![]() - собственные векторы –
решения уравнения
- собственные векторы –
решения уравнения
![]() (3.5)
(3.5)
3.2. Метод квазистационарных концентраций
Схема применения метода квазистационарных концентраций:
1) выделяем короткоживущие промежуточные вещества Bi ;
2) полагаем
концентрации этих веществ стационарными: 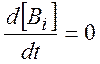 ;
;
3) из полученных алгебраических уравнений выражаем концентрации веществ Bi через концентрации остальных веществ;
4) решаем упрощенную систему дифференциальных уравнений (с меньшим числом переменных);
5) оцениваем время установления квазистационарных концентраций и проверяем, выполняется ли условие, что время жизни Bi много меньше времени протекания реакции.
3.3. Лимитирующая стадия сложного процесса
Рассмотрим реакцию
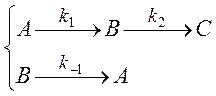 (3.6)
(3.6)
Записываем систему дифференциальных уравнений:
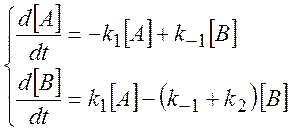 (3.7)
(3.7)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.