1. Цель работы
Изучение зависимости состава пара от состава раствора. Исследование перегонки бинарных неограниченно смешивающихся жидкостей. Построение диаграммы: температура кипения - состав.
2. Бинарные неограниченно смешивающиеся жидкости.
При смешивании двух жидкостей могут наблюдаться всевозможные случаи взаимной растворимости - от практически полной нерастворимости (вода и ртуть) до образования однородного раствора (этиловый спирт - вода).
Рассмотрим случай неограниченно смешивающихся жидкостей.
Насыщенный пар, находящийся в равновесии с жидким раствором содержит, в общем случае, все компоненты раствора, и давление пара является суммой парциальных давлений компонентов. Суммарное давление насыщенного пара и парциальные давления являются функциями температуры и состава раствора и могут быть представлены несколькими типами кривых. 2.1. Идеальные растворы.
Если две жидкости А и В близки по химическим свойствам (например, смеси изомеров или гомологов), то силы взаимодействия между однородными частицами (А - А, В - В) того же порядка, что и между разнородными (А - В), и в этом случае образование раствора происходит без изменений объёма и не сопровождается заметным тепловым эффектом (ΔV=0), (ΔН=0). Такой раствор называется идеальным и во всей области концентрации подчиняется закону Рауля, то есть парциальное давление каждого компонента при каждой температуре пропорционально его мольной доле в растворе:
![]() (2.1)
(2.1)
![]() (2.2)
(2.2)
где ![]() и
и ![]() - давление пара над чистыми веществами,
соответственно над А и В.
- давление пара над чистыми веществами,
соответственно над А и В.
Мольная доля каждого компонента равна отношению числа молей к общему числу молей в растворе и для бинарного раствора, (состоящего из двух компонентов):
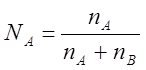 ;
; 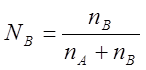 ; NA+NB=1
; NA+NB=1
Общее давление пара над раствором равно сумме парциальных давлений:
![]() (2.3)
(2.3)
Примерами растворов, близких к идеальным, могут служить смесь хлорбензол - бромбензол и др.
На рис. 2.1 представлена зависимость парциальных давлений и общего давления пара от состава при постоянной температуре для системы C6H5Cl - C6H5Вr, по свойствам близкой к идеальному раствору. Общее и парциальное давление над системой при 140°С. Система C6H5CI - C6H5Вr. Т =const.
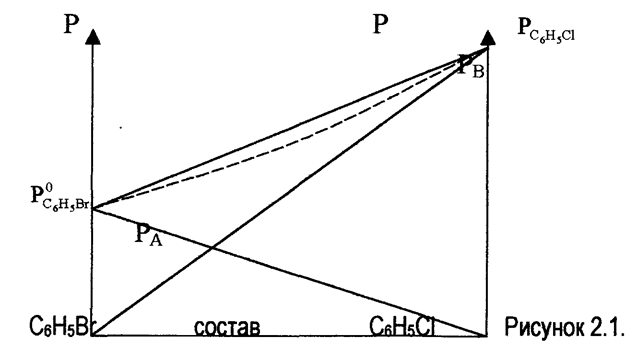
Парциальное давление бромбензола
(компонент А) изменяется прямолинейно от ![]() (чистый
бромбензол
na = 1) до нуля при (nа = 0). Аналогично
парциальное давление хлорбензола (компонент В) изменяется от
(чистый
бромбензол
na = 1) до нуля при (nа = 0). Аналогично
парциальное давление хлорбензола (компонент В) изменяется от ![]() (при NВ = 1) до нуля
(при
nb = 0). В соответствии с этим и общее давление пара
изменяется прямолинейно. Применяя к парам законы идеальных газов (что
допускается при не слишком высоких давлениях), можно из парциальных давлений
пара компонентов вычислить состав пара и таким образом установить связь между
составами жидкости и пара.
(при NВ = 1) до нуля
(при
nb = 0). В соответствии с этим и общее давление пара
изменяется прямолинейно. Применяя к парам законы идеальных газов (что
допускается при не слишком высоких давлениях), можно из парциальных давлений
пара компонентов вычислить состав пара и таким образом установить связь между
составами жидкости и пара.
Уравнение Менделеева - Клайперона может быть применимо как к отдельным компонентам, так и к смеси паров, те есть:
![]() (2.4)
(2.4)
![]() (2.5)
(2.5)
![]() (2.6)
(2.6)
где V - общий объём пара;
nA, nB - число молей компонентов А и В в парах;
R - газовая постоянная. При делении уравнений (2.4) и (2.5) на уравнение (2.6) получим:
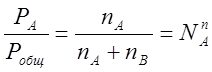 (2.7)
(2.7)
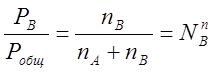 (2.8)
(2.8)
где ![]() ,
, ![]() - мольные доли компонентов А и В в паре.
- мольные доли компонентов А и В в паре.
Вычислив давление и состав пара для нескольких растворов, можно провести на рис 2, 1 пунктирную кривую, дающую связь между составом пара и общим давлением пара над раствором.
Разделив (2.7) на (2.8) и подставив вместо парциальных давлений ра и РB их значения по закону Рауля (2.1), (22), получим:
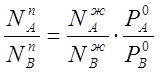 (2.9)
(2.9)
где ![]() и
и ![]() - мольные доли компонентов А и В в растворе (жидкой фазе).
Отношения мольных долей компонентов характеризуют состав пара и жидкости. Тогда
из уравнения (2.9) видно что у идеальных растворов состав пара должен
отличаться состава этой жидкости, если только величины давления пара над
чистыми веществами не равны друг другу. Состав пара отличается от состава
жидкости также и у неидеальных растворов, за исключением особых случаев
образования азеотропных растворов.
- мольные доли компонентов А и В в растворе (жидкой фазе).
Отношения мольных долей компонентов характеризуют состав пара и жидкости. Тогда
из уравнения (2.9) видно что у идеальных растворов состав пара должен
отличаться состава этой жидкости, если только величины давления пара над
чистыми веществами не равны друг другу. Состав пара отличается от состава
жидкости также и у неидеальных растворов, за исключением особых случаев
образования азеотропных растворов.
2.2. Реальные растворы
Большинство реальных растворов отличается по свойствам от идеальных. Всякое более или менее интенсивное взаимодействие между частицами, составляющими раствор, вызывает в растворах отклонение от идеального поведения (от закона Рауля) различных типов. 2.2.1. Положительные отклонения от закона Рауля
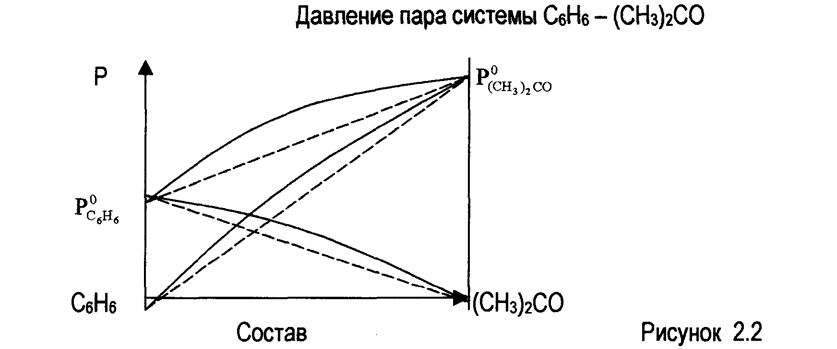
Они наблюдаются, если силы взаимодействия между однородными частицами (А - А или В - В) больше, чем между разнородными (А - В), что облегчает переход молекул из жидкой фазы в газообразную (по сравнению с чистыми жидкостями). Это бывает при различии в полярности компонентов раствора, если одно из веществ ассоциировано, тогда образование раствора сопровождается обычно поглощением тепла и теплота испарения компонентов из раствора в связи с этим уменьшается, что облегчает процесс испарения. Поэтому давление пара над системой (сплошные линии на рис 2.2) сказывается большим, чем вычисленные по закону Рауля (пунктирные линии на рис 2.2), общее давление больше аддитивной величины и схематически представлено на рис 2.2.
Примеры растворов с положительными отклонениями от закона Рауля:
Вода - метиловый спирт;
Этиловый спирт - этиловый эфир;
Ацетон - этиловый спирт.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.