2.2.2. Отрицательные отклонения от закона Рауля
Наблюдается значительно реже и в том случае, если силы взаимодействия между однородными частицами (А - А, В - В) меньше, чем между разнородными.
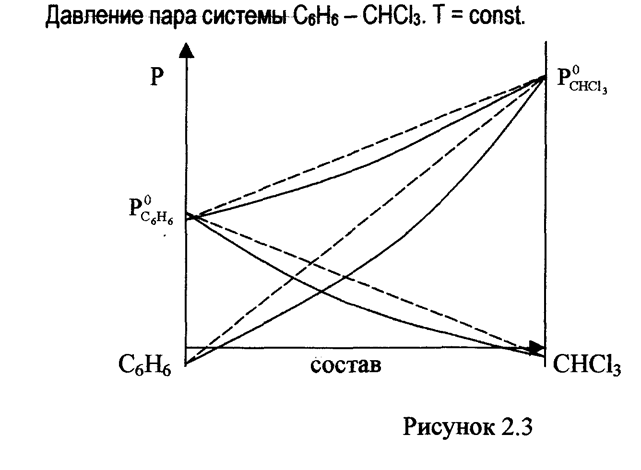
В этом случае усиление взаимного притяжения молекул в растворе (сольватация, образование водородной связи, образование химического соединения) затрудняет переход молекул в газообразную фазу, образование раствора при этом происходит с выделением тепла, в связи с чем теплота испарения увеличивается. Это затрудняет процесс испарения и давление пара над системой оказывается меньшим (сплошные линии на рис 2.3), чем вычисленное по закону Рауля (пунктирные линии на рис 2.3).
Примеры растворов с отрицательными отклонениями от закона Рауля:
Вода - азотная кислота;
Вода - хлористый водород;
Хлороформ - бензол;
Хлороформ - ацетон.
Величины общего давления в случае положительных и отрицательных отклонений от закона Рауля изменяются монотонно с изменением мольной доли одного из компонентов.
Если эти отклонения велики, то кривая общего давления пара проходит через максимум или через минимум. Чем ближе между собой давление насыщенного пара чистых жидкостей, тем меньше положительные или отрицательные отклонения парциальных давлений от закона Рауля вызывают появления экстремума на кривой общего давления.
3. Состав пара растворов. Законы Коновалова. Азеотропные смеси
В случае летучести обоих компонентов в чистом состоянии пар будет содержать оба компонента: относительное же содержание компонентов в парах в общем случае будет отличаться от относительного содержания их в жидкости.
Состав пара над раствором (жидкостью) равен составу раствора (жидкости):
1) в системе, компоненты которой обладают одинаковым давлением пара в
чистом состоянии (![]() ); (пример: смеси оптических
изомеров);
); (пример: смеси оптических
изомеров);
2) над чистыми жидкостями;
3) над азеотропными растворами.
В паре будет всегда преобладать по сравнению с жидкостью тот из компонентов, который обладает большим давлением пара в чистом состоянии.
Зависимость состава пара от состава раствора и общего давления характеризуется двумя законами Д. П. Коновалова:
I закон: - пар по сравнению с жидкостью, находящейся с ним в равновесии, богаче тем компонентом, добавление которого к жидкости повышает общее давление пара (или температуру кипения раствора при заданном давлении).
Выражение (2.9) математически выражает I закон Коновалова.
Если ![]() , то
, то 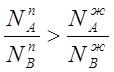 , то есть пар в этом случае обогащен
компонентом А, наиболее летучим.
, то есть пар в этом случае обогащен
компонентом А, наиболее летучим.
Можно дать более простую формулировку I закона Коновалова: парообразная фаза по сравнению с жидкой обогащена наиболее летучим компонентом, то есть компонентом, температура кипения которого ниже. Так на рис 2.1 парообразная фаза богаче хлорбензолом, на рис 2.2 - ацетоном, на рис 2.3 - хлороформом.
На различии состава пара и жидкости в двухкомпонентных системах основано их разделение с помощью перегонки. Однократным испарением нельзя разделить смесь двух летучих веществ, так в парах присутствуют оба компонента. Для разделения смеси следует вести фракционную перегонку, осуществляемую обычно при постоянном давлении.
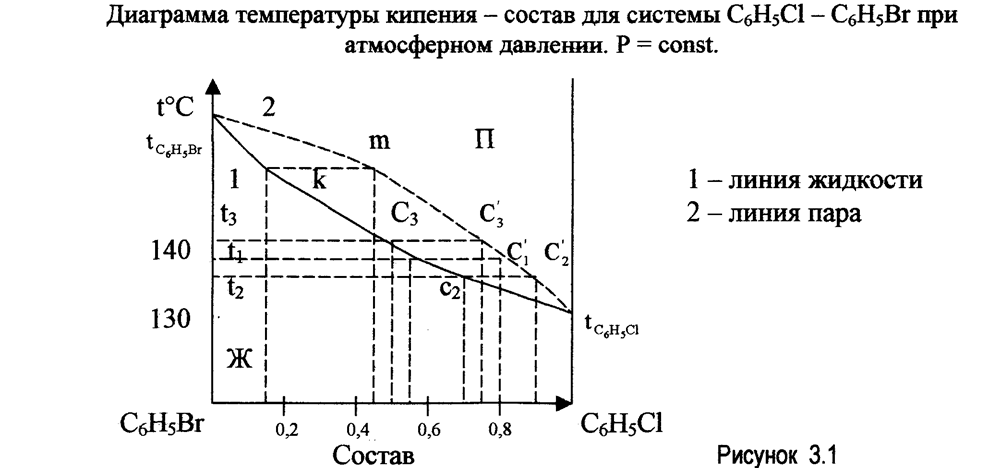
На рис 3.1 представлена зависимость температуры кипения раствора от состава системы С6Н5С1 - С6Н5Вг при атмосферном давлении. Более летучий компонент (в данном случае С6Н5С1) имеет более низкую температуру кипения.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.