Еще раз отметим, что работа А существенным образом
зависит от процесса (или
«пути»), по которому система переводится
из состояния 1 в состояние 2. Это наглядно 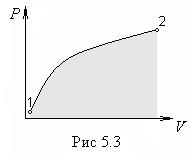 видно из графика на рис.5.3, где изображен
процесс изменения объема на диаграмме р,
V.
видно из графика на рис.5.3, где изображен
процесс изменения объема на диаграмме р,
V.
Мы знаем, что геометрическая интерпретация интеграла (5.7) — это «площадь» под кривой 1—2, а эта площадь зависит от вида кривой, т. е. от процесса.
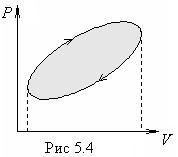 Если в
результате изменений макросистема возвращается в исходное состояние, то
говорят, что она совершила круговой процесс или цикл. На
диаграмме р, V
Если в
результате изменений макросистема возвращается в исходное состояние, то
говорят, что она совершила круговой процесс или цикл. На
диаграмме р, V
такой процесс имеет вид
замкнутой кривой (рис.5.4.). Работа, совершаемая системой за цикл, численно
равна площади внутри цикла, тонированной на рисунке. При этом, если точка, изображающая состояние системы, описывает цикл по часовой стрелке
(как на рисунке 5.4), то работа
системы А > 0. Если же против часовой
стрелки, то А < 0.
Знак работы зависит от знака dV: на тех участках процесса, где dV>0, работа А > 0, на тех же участках, где dV < 0, и А < 0.
Теплоемкостью тела называется величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на 1 Кельвин:
![]() .
.
Теплоемкость моля вещества называется молярной теплоемкостью,
![]()
Теплоемкость единицы массы вещества называется удельной теплоемкостью
![]()
Теплоемкость, так же как и количество теплоты Q, зависит от процесса и в разных процессах различна.
Определим
значение молярных теплоемкостей при постоянном объеме ![]() и
при постоянном давлении
и
при постоянном давлении ![]() для
однородного идеального газа.
для
однородного идеального газа.
Если нагревание происходит при постоянном объеме, V=const, то система не совершает работы над внешними телами, и первое начало термодинамики запишем в виде:
![]()
- все тепло идет на приращение внутренней энергии тела. Молярная теплоемкость равна
![]()
Здесь
i –число степеней свободы молекул газа. Для
одноатомного газа i=3 и ![]() Для двухатомного
газа i=6 ,
Для двухатомного
газа i=6 , ![]() , т.е. в два
раза больше, чем для одноатомного газа.
, т.е. в два
раза больше, чем для одноатомного газа.
При
комнатных температурах для двухатомного газа i можно
считать равным 5, поэтому ![]() (отсутствует одна
вращательная степень свободы). В случае многоатомных газов
(отсутствует одна
вращательная степень свободы). В случае многоатомных газов ![]() (если отсутствует колебательная
степень свободы, и молекулы можно считать точками)
(если отсутствует колебательная
степень свободы, и молекулы можно считать точками)
Рассмотрим процесс нагревания газа при постоянном давлении. Газ в этом случае
будет расширяться и совершать работу над внешними телами, значит, для повышения
температуры газа на 1К понадобиться больше тепла, чем при постоянном объёме,
т.е. ![]() . Уравнение первого начала
термодинамики для моля газа имеет вид:
. Уравнение первого начала
термодинамики для моля газа имеет вид:
![]() .
.
Индекс
![]() означает, что соответствующая величина
берется для моля вещества. Разделим это уравнение на dT:
означает, что соответствующая величина
берется для моля вещества. Разделим это уравнение на dT:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.