Лекция 8
5. ТЕРМОДИНАМИКА
Термодинамика явилась первой наукой, на основе которой стало возможным статистическое изучение макросвойств и процессов для произвольных систем с числом частиц N>>1. При термодинамическом подходе о макросвойствах системы судят на основе обобщенных исследований. К числу этих исследований относятся изучения:
1) процессов взаимопревращения теплоты и работы;
2) обратимых и необратимых процессов;
3) процессов при низких температурах.
Аналитическое обобщение такого рода опытов позволяет сформулировать три закона термодинамики, которые можно записать в виде дифференциальных уравнений и которые составляют его фундамент. Такой метод исследования называют феноменологическим. Он присущ и другим разделам физики(механика, электростатика и др.). При феноменологическом подходе полностью используются молекулярно-кинетические представления, поэтому выводы полученные в этих рамках, не позволяют глубоко вскрыть природу изучаемых явлений. Оставаясь в рамках термодинамики невозможно обосновать законы термодинамики. Это свидетельствует об ограниченности феноменологического подхода. Эти законы термодинамики можно лишь обосновать на основе статистического метода.
5.1.Основные понятия термодинамики
1.Работа. Рассмотрим макроскопическую
систему А. Энергия этой системы зависит от свойств самой системы и от
внешних условий. Внешние условия в которых находится система, можно
охарактеризовать заданием внешних параметров (например, координат). Энергия
является функцией внешних параметров ![]() .
.
Рассмотрим теперь изменение энергии системы при бесконечно малом изменении параметра а, при котором распределение вероятностей различных состояний остается неизменным. Это означает, что при изменении параметра а система не переходит из одного микросостояния в другое. В таком случае имеем:
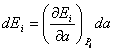 .
(5.1)
.
(5.1)
Производную
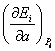 можно рассматривать как некоторую
обобщенную силу, действующую на систему. За счет этой силы происходит изменение
координаты а до значения a+da и изменение энергии системы на
величину
можно рассматривать как некоторую
обобщенную силу, действующую на систему. За счет этой силы происходит изменение
координаты а до значения a+da и изменение энергии системы на
величину ![]() , где
, где
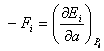 ,
,
![]() – энергия системы в i-том микросостоянии.
– энергия системы в i-том микросостоянии.
Переходя в выражении(1) к средним значениям, имеем:
![]() .
.
Величину
![]() можно рассматривать как обобщенную
силу, действующую на макроскопическую систему и приводящую к изменению
координаты а. Величину
можно рассматривать как обобщенную
силу, действующую на макроскопическую систему и приводящую к изменению
координаты а. Величину ![]() по аналогии с
механической можно рассматривать как работу, производимую над макроскопической
системой при изменении координаты на dа. Знак ‘’-’’ означает, что
работа совершается внешними силами. В термодинамике процесс изменения энергии
макроскопической системы при изменении внешних параметров называется работой. С
молекулярной точки зрения, совершение работы связано с изменением значений
энергии микросостояния. Эти изменения значений энергии связаны с изменением
внешних параметров. Распределение же вероятностей различных состояний остается
неизменным.
по аналогии с
механической можно рассматривать как работу, производимую над макроскопической
системой при изменении координаты на dа. Знак ‘’-’’ означает, что
работа совершается внешними силами. В термодинамике процесс изменения энергии
макроскопической системы при изменении внешних параметров называется работой. С
молекулярной точки зрения, совершение работы связано с изменением значений
энергии микросостояния. Эти изменения значений энергии связаны с изменением
внешних параметров. Распределение же вероятностей различных состояний остается
неизменным.
2.Квазистатические и нестатические процессы. Процессы, при которых макроскопическая система все время находится в равновесии (или точнее, в ходе которых система проходит через последовательный ряд равновесных состоянии) называется равновесным или квазистатическими.
Состояние считается равновесным, если во всех точках системы параметры состояния (p,V,T) одинаковы. Если какой - либо параметр состояния системы в её различных точках неодинаков, то состояние является неравновесным. Если такую систему предоставить самой себе, то значения параметра выравниваются, и система приходит в состояние равновесия.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.