Квазистатический процесс легко представить, если реальная скорость процесса ![]() много меньше скорости
восстановления равновесия. В этом случае при реальных изменениях с малой
скоростью равновесие восстанавливается с большой скоростью, и при реальном
изменении состояния макроскопической системы эта система проходит через ряд
равновесных состояний.
много меньше скорости
восстановления равновесия. В этом случае при реальных изменениях с малой
скоростью равновесие восстанавливается с большой скоростью, и при реальном
изменении состояния макроскопической системы эта система проходит через ряд
равновесных состояний.
Рассмотрим макроскопическую систему А, взаимодействующую с термостатом В.
Будем считать давление макроскопической системы А равным р, а
давление термостата (р+![]() ). Тогда за счет
бесконечно малого перепада давление
). Тогда за счет
бесконечно малого перепада давление ![]() начинается процесс
выравнивания давления - система А начинает сжиматься. Если бы переход
давления был равен нулю, то процесс отсутствовал бы, и его скорость была бы
равна нулю. При бесконечно малом перепаде
начинается процесс
выравнивания давления - система А начинает сжиматься. Если бы переход
давления был равен нулю, то процесс отсутствовал бы, и его скорость была бы
равна нулю. При бесконечно малом перепаде ![]() скорость
процесс бесконечно мала, а скорость
скорость
процесс бесконечно мала, а скорость ![]() процесса
восстановленного равновесия в газе конечна, т.е.
процесса
восстановленного равновесия в газе конечна, т.е. ![]() ,
и процесс сжатия газа будет проходить через последовательность равновесных
состояний, т.е. квазистатически.
,
и процесс сжатия газа будет проходить через последовательность равновесных
состояний, т.е. квазистатически.
Такой процесс называют обратимым, т.к. достаточно бесконечно малых условий, и
процесс потечет в обратном направлении, то есть если давление газа будет p+![]() , а термостата р, то газ будет
расширяться, проходя квазистатически через те же состояния, но в обратном
порядке.
, а термостата р, то газ будет
расширяться, проходя квазистатически через те же состояния, но в обратном
порядке.
В термодинамике
обратимыми процессами называют такие процессы, которые могут протекать как в
прямом, так в обратном направлениях без заметных (конечных) изменений в
окружающей среде. Если же скорость протекания процесса много больше скорости
восстановления равновесия, ![]() , то процесс
называется нестатическим или неравновесным. В этом случае система проходит
ряд неравновесных состояний. Физически такая ситуация встречается тогда, когда
имеет место конечный перепад (градиент) параметров системы А и
термостата В. Такие процессы называют еще необратимыми, т.к. бесконечно
малых изменений условий в конечном состоянии будет недостаточно, чтобы вернуть
систему в исходное состояние, т.е. процесс нельзя обратить без конечных
изменений в окружающей среде.
, то процесс
называется нестатическим или неравновесным. В этом случае система проходит
ряд неравновесных состояний. Физически такая ситуация встречается тогда, когда
имеет место конечный перепад (градиент) параметров системы А и
термостата В. Такие процессы называют еще необратимыми, т.к. бесконечно
малых изменений условий в конечном состоянии будет недостаточно, чтобы вернуть
систему в исходное состояние, т.е. процесс нельзя обратить без конечных
изменений в окружающей среде.
3.Полное изменение энергии равновесной системы. Рассмотрим систему А, которая находится в состоянии равновесия. Полное изменение средней энергии системы определяется выражением:
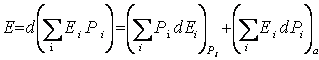 .
(5.2)
.
(5.2)
Первое
слагаемое в выражении (5.2) - это работа ![]() ,
совершаемая над системой. Второе слагаемое - это та часть изменения энергии
макроскопической системы, находящейся во взаимодействии с термостатом, которая
не связана с изменением внешних параметров (а=const). Это вклад в
изменение средней энергии системы за счет непрерывной передачи энергии от
частиц термостата В к частицам системы А. Если внешние параметры
не меняются, то энергия отдельных микросостояний не меняется, и энергия,
подводимая к макроскопической системе извне, идет на изменение распределения
вероятностей. Состояние с большей энергией становятся более вероятными -
система нагревается. Эту часть изменения полной энергии называют теплотой dQ.
Итак, имеем:
,
совершаемая над системой. Второе слагаемое - это та часть изменения энергии
макроскопической системы, находящейся во взаимодействии с термостатом, которая
не связана с изменением внешних параметров (а=const). Это вклад в
изменение средней энергии системы за счет непрерывной передачи энергии от
частиц термостата В к частицам системы А. Если внешние параметры
не меняются, то энергия отдельных микросостояний не меняется, и энергия,
подводимая к макроскопической системе извне, идет на изменение распределения
вероятностей. Состояние с большей энергией становятся более вероятными -
система нагревается. Эту часть изменения полной энергии называют теплотой dQ.
Итак, имеем:
![]() . (5.3)
. (5.3)
Знаки в уравнении (5.3) определим следующим образом. Энергию, полученную системой А, будем считать положительной, а отдаваемую - отрицательной. Если dQ>0 - система получает теплоту (эндотермический процесс). Если dQ<0 - система отдает теплоту (экзотермический процесс).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.