Закон Дальтона. Давление смеси газов равно сумме их парциальных давлений
![]() .
.
Тепловое равновесие двух тел – состояние контактирующих тел, при котором количество энергии, передаваемой от первого тела второму, равно количеству энергии, передаваемой от второго тела первому. Любые тела, приведенные в контакт друг с другом, с течением времени приходят в состояние теплового равновесия.
Тепловое равновесие тела – состояние тела, при котором все его части находятся друг с другом в тепловом равновесии.
Температура (абсолютная или термодинамическая температура) (Т) – характеристика теплового равновесия тела (качественное определение). В системе СИ единица температуры является одной из основных и называется кельвин (К). Определяющая формула для температуры идеального газа
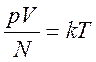 .
.
Здесь k = 1,38×10–23 Дж/К – постоянная Больцмана (коэффициент пропорциональности, значение которого выбрано таким, чтобы интервалы температур в 1 К и 1 0С совпадали между собой).
|
|
Температуры тел, находящихся в тепловом равновесии, равны между собой, поэтому температуру любого тела можно определить как температуру идеального газа, который находится в тепловом равновесии с этим телом.
Связь температурных шкал (рисунок 2)
![]() .
.
Температура газа определяет среднюю кинетическую энергию поступательного движения молекулы идеального газа
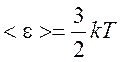 .
.
Связь среднеквадратичной скорости молекул газа с его температурой
vкв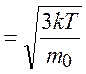 .
.
Зависимость давления идеального газа от его температуры и концентрации молекул
p = nkT.
Универсальная газовая постоянная равна произведению постоянной Aвогадро на постоянную Больцмана
R = NАk = 8,31 Дж/(моль×К).
Уравнение состояния идеального газа (уравнение Менделеева-Клапейрона)
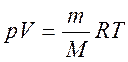 .
.
Из уравнения состояния идеального газа может быть определена плотность газа r по соотношению
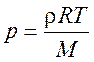 .
.
Изотермический процесс – процесс, протекающий при постоянной температуре. При постоянной температуре и неизменных массе и молярной массе газа выполняется закон Бойля-Мариотта (уравнение изотермического процесса)
pV = const.
График изотермического процесса называется изотермой (график на рисунке 3 приведен при двух значениях температуры).
Изохорный процесс – процесс, протекающий при неизменном объеме. При постоянном объеме и неизменных массе и молярной массе газа выполняется закон Шарля (уравнение изохорного процесса)
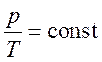 .
.
График изохорного процесса называется изохорой (график на рисунке 4 приведен при двух значениях объема).
|
|
|
|
Рисунок 3 |
Рисунок 4 |
|
Рисунок 5 |
Изобарный процесс – процесс, протекающий при постоянном давлении. При постоянном давлении и неизменных массе и молярной массе газа выполняется закон Гей-Люссака (уравнение изобарного процесса)
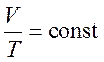 .
.
График изобарного процесса называется изобарой (график на рисунке 5 приведен при двух значениях давления).
Внутренняя энергия тела (U) (с позиций молекулярно-кинетической теории) – сумма потенциальной энергии взаимодействия частиц, из которых состоит тело, и кинетической энергии их теплового движения. Если происходят изменения в строении молекул или движении атомов, то во внутреннюю энергию также включают потенциальную энергию взаимодействия атомов в молекуле и кинетическую энергию движения атомов. Если происходят изменения в строении атомов, то рассматривают также потенциальную энергию взаимодействия электронов и ядра, а также кинетическую энергию движения электронов в атоме. И так далее, В зависимости от происходящих процессов. В любом случае во внутреннюю энергию не входит потенциальная энергия тела в гравитационном поле и кинетическая энергия движения тела как целого.
Внутренняя энергия идеального газа – суммарная кинетическая энергия беспорядочного теплового движения его молекул. В соответствии с основным уравнением молекулярно-кинетической энергии идеального газа она может быть определена по соотношениям
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.