МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕПЛОВЫЕ ЯВЛЕНИЯ
Основные положения молекулярно-кинетической теории:
1. Вещество состоит из частиц – атомов и молекул.
2. Эти частицы находятся в постоянном хаотическом движении (тепловом движении).
3. Частицы взаимодействуют друг с другом.
Взаимодействие молекул между собой слабее всего у газов и сильнее всего у твердых тел. Взаимодействие молекул в жидкостях по силе занимает промежуточное положение. Взаимодействие между атомами и молекулами проявляется силами притяжения и отталкивания. При сближении двух молекул сначала преобладают силы притяжения. На некотором расстоянии между их центрами (положение равновесия) силы отталкивания и притяжения сравниваются между собой. При дальнейшем сближении силы отталкивания становятся преобладающими.
В газах обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул, поэтому силы отталкивания и притяжения между молекулами практически отсутствуют. В твердых телах и жидкостях расстояния между атомами и молекулами в среднем по порядку величины равны размерам молекул.
Движение молекул в газах представляет собой свободный полет с периодическими столкновениями с другими молекулами и стенками сосуда. В твердых телах молекулы совершают беспорядочные колебания около постоянных положений равновесия. В жидкостях движение молекул состоит из колебаний около одних положений равновесия (как в твердых телах) и периодических перескоков в другие положения равновесия.
Основные опыты, обосновывающие положения теории, особенности строения тел и молекулярного движения в них: Способность газов неограниченно расширяться; способность жидкости принимать форму сосуда; способность твердых тел сохранять свою форму; упругость газов, жидкостей и твердых тел; способность к взаимному проникновению тел путем диффузии, броуновское движение, наблюдение строения кристаллических тел с помощью ионного проектора, наблюдение отдельных атомов и молекул в электронном микроскопе, закон кратных отношений при образовании соединений различных веществ (в химии).
Броуновское движение – беспорядочное движение видимых в микроскоп твердых частиц, взвешенных в жидкости. Объясняется хаотическими ударами молекул жидкости.
Количество вещества – физическая величина, пропорциональная количеству числу частиц (молекул) в веществе. Единица количества вещества в системе СИ – 1 моль.
Моль равен количеству вещества, содержащего столько же частиц, сколько содержится атомов в 0,012 кг углерода 12С.
Постоянная Авогадро – отношение числа молекул N вещества к количеству вещества n. Определяющая формула
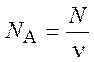 .
.
Иначе, постоянная Авогадро (число Авогадро) – число молекул в одном моле вещества. В системе СИ единицей постоянной Авогадро является 1/моль.
Молярная масса – физическая величина, равная отношению массы вещества к количеству вещества. Определяющая формула
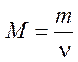 .
.
В системе СИ единицей молярной массы является 1 кг/моль.
Молярную массу вещества можно рассчитать с помощью Периодической системы Д.И. Менделеева. Для этого надо определить, так называемую, относительную молекулярную массу его молекулы как сумму относительных атомных масс ее атомов (значения берутся из таблицы Менделеева), а затем умножить ее на множитель 10–3 кг/моль. Например для углекислого газа (молекула СО2) получим:
М = (12 + 16 + 16)×10–3 кг/моль = 44 кг/моль.
|
Рисунок 1 |
Концентрация молекул – физическая величина, равная отношению числа молекул к объему, занимаемому газом. Определяющая формула
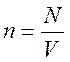 .
.
Связь между различными характеристиками, описывающими количество вещества (в широком смысле), представлена на рисунке 1 (m0 – масса одной молекулы).
Идеальный газ – модель газа, в которой пренебрегается собственным объемом молекул (молекулы – материальные точки), между молекулами не действуют силы притяжения, при столкновениях молекул между собой и со стенками сосуда действуют силы отталкивания. Все достаточно разреженные газы (например, при нормальных условиях – см. ниже) по свойствам близки к идеальному. При увеличении давления и уменьшении температуры свойства реальных газов начинают все больше отличаться от свойств идеального газа.
Среднее значение квадрата скорости молекул (![]() ) – среднее арифметическое от
квадратов значений мгновенных скоростей всех молекул газа, взятых в один и тот
же момент времени
) – среднее арифметическое от
квадратов значений мгновенных скоростей всех молекул газа, взятых в один и тот
же момент времени
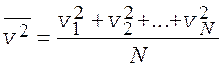 .
.
Квадратный корень из этой величины называют среднеквадратичной скоростью
vкв =![]() .
.
Основное уравнение молекулярно-кинетической теории идеального газа (p – давление газа)
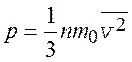 .
.
Следствия из основного уравнения:
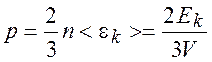 ,
,
где 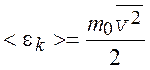 – среднее значение кинетической энергии
поступательного движения молекулы идеального газа;
– среднее значение кинетической энергии
поступательного движения молекулы идеального газа; ![]() – суммарная кинетическая энергия поступательного движения всех молекул.
– суммарная кинетическая энергия поступательного движения всех молекул.
Парциальное давление одного из газов в смеси – давление, которое производил бы данный газ, если бы все остальные газы смеси убрать из сосуда.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.