






В данном документе рассматривается численное моделирование лавины в сильно неоднородном поле. Для расчета выбрана система электродов сфера-сфера.
В модели учитываются частицы следующих типов:
Электроны (обозначение в CFD-ACE - E). Задан заряд и масса. Такие свойства, как подвижность и диффузия не задаются – движение электронов рассчитывается через уравнение Фоккера-Планка.
N2 (N2). Молекулярный азот.
N (N). Атомарный азот. Образуется в результате диссоциации азота.
N2+ (N2+). Положительный ион молекулярного азота. Задана подвижность.
В объеме заданы следующие реакции.
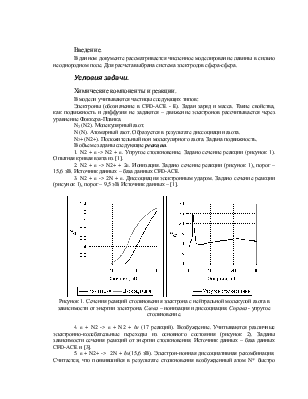
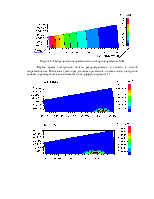
1. N2 + e -> N2 + e. Упругое столкновение. Задано сечение реакции (рисунок 1). Опытная кривая взята из [1].
2. N2 + e -> N2+ + 2e. Ионизация. Задано сечение реакции (рисунок 1), порог – 15,6 эВ. Источник данных – база данных CFD-ACE.
3. N2 + e -> 2N + e. Диссоциация электронным ударом. Задано сечение реакции (рисунок 1), порог – 9,5 эВ. Источник данных – [1].
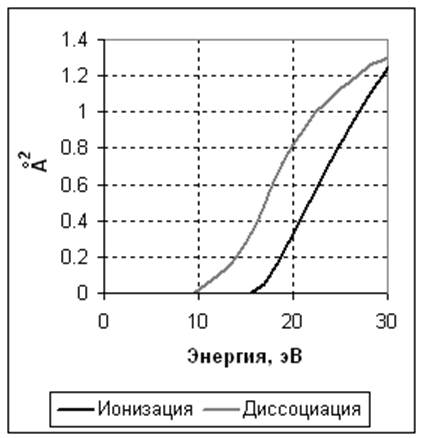
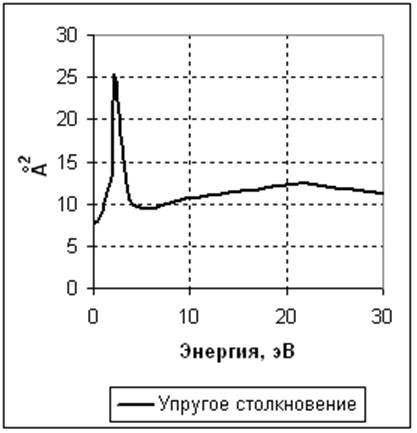
Рисунок 1. Сечения реакций столкновения электрона с нейтральной молекулой азота в зависимости от энергии электрона. Слева – ионизация и диссоциация. Справа - упругое столкновение.
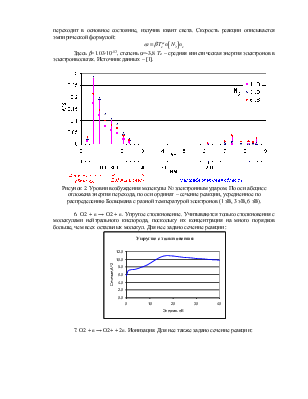
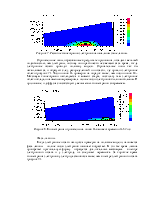
4. e + N2 -> e + N2 + hν (17 реакций). Возбуждение. Учитываются различные электронно-колебательные переходы из основного состояния (рисунок 2). Заданы зависимости сечения реакций от энергии столкновения. Источник данных – база данных CFD-ACE и [3].
5. e + N2+ -> 2N + hν(15,6 эВ). Электрон-ионная диссоциативная рекомбинация. Считается, что появившийся в результате столкновения возбужденный атом N* быстро переходит в основное состояние, излучив квант света. Скорость реакции описывается эмпирической формулой:
![]()
Здесь β=1.03∙10-12, степень α=-3,8 Te – средняя кинетическая энергия электронов в электронвольтах. Источник данных – [1].
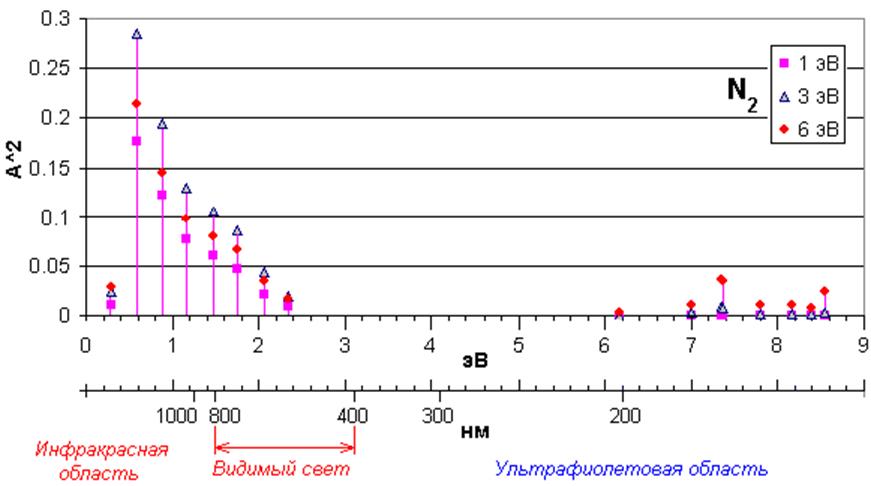
Рисунок 2. Уровни возбуждения молекулы N2 электронным ударом. По оси абсцисс отложена энергия перехода, по оси ординат – сечение реакции, усредненное по распределению Больцмана с разной температурой электронов (1 эВ, 3 эВ, 6 эВ).
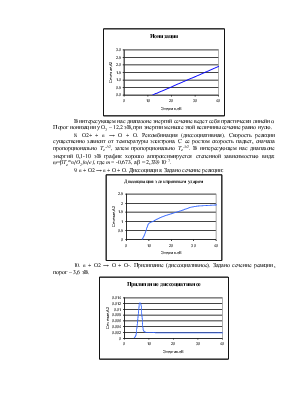
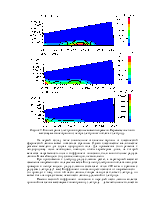
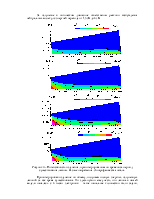
6. O2 + e → O2 + e. Упругое столкновение. Учитываются только столкновения с молекулами нейтрального кислорода, поскольку их концентрация на много порядков больше, чем всех остальных молекул. Для нее задано сечение реакции:
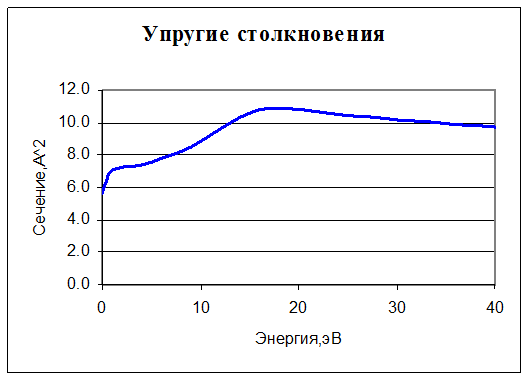
7. O2 + e → O2+ + 2e. Ионизация. Для нее также задано сечение реакции:
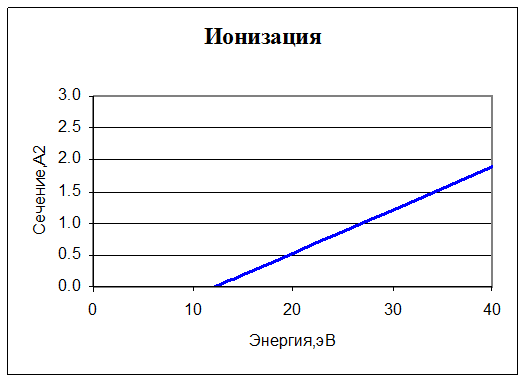
В интересующем нас диапазоне энергий сечение ведет себя практически линейно. Порог ионизации у O2 – 12,2 эВ, при энергии меньше этой величины сечение равно нулю.
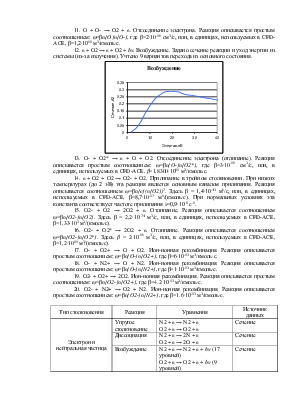
8. O2+ + e → O + O. Рекомбинация (диссоциативная). Скорость реакции существенно зависит от температуры электрона. С ее ростом скорость падает, сначала пропорционально Te-1/2, затем пропорционально Te-3/2. В интересующем нас диапазоне энергий 0,1-10 эВ график хорошо аппроксимируется степенной зависимостью вида: ω=βTemn[O2]n[e], где m = -0,673, а β = 2,338∙10-7.
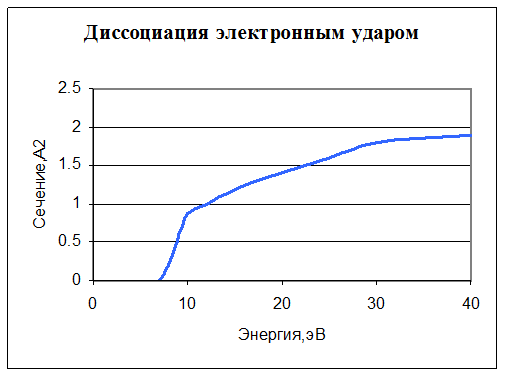
9. e + O2 → e + O + O. Диссоциация. Задано сечение реакции:
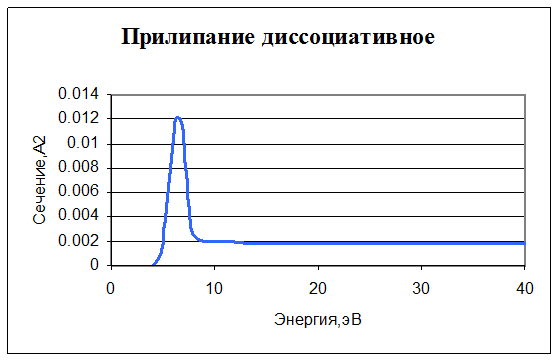
10. e + O2 → O + O-. Прилипание (диссоциативное). Задано сечение реакции, порог – 3,6 эВ.
11. O + O- → O2 + e. Отсоединение электрона. Реакция описывается простым соотношением: ω=βn[O]n[O-], где β=2∙10-10 см3/с, или, в единицах, используемых в CFD-ACE, β=1,2∙1011 м3/кмоль∙с.
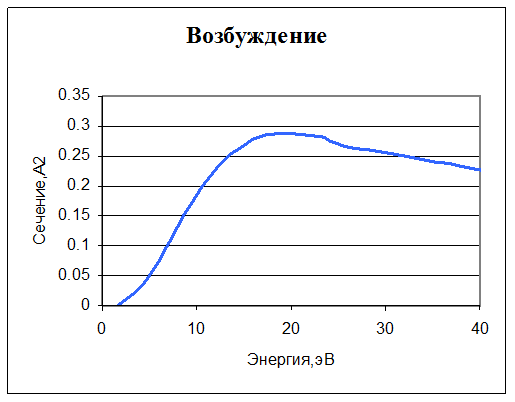
12. e + O2 → e + O2 + hν. Возбуждение. Задано сечение реакции и уход энергии из системы (из-за излучения). Учтено 9 вариантов перехода из основного состояния.
13. O- + O2* → e + O + O2. Отсоединение электрона (отлипание). Реакция описывается простым соотношением: ω=βn[O-]n[O2*], где β=3∙10-10 см3/с, или, в единицах, используемых в CFD-ACE, β=1,8300∙1011 м3/кмоль∙с.
14. e + O2 + O2 → O2- + O2. Прилипание в тройном столкновении. При низких температурах (до 2 эВ) эта реакция является основным каналом прилипания. Реакция описывается соотношением ω=βn[e](n[O2])2. Здесь β = 1,4∙10-43 м6/с, или, в единицах, используемых в CFD-ACE, β=8,7∙10-17 м6/(кмоль∙с). При нормальных условиях эта константа соответствует частоте прилипания ν=0,9∙10-8 с-1.
15. O2- + O2 → 2O2 + e. Отлипание. Реакция описывается соотношением ω=βn[O2-]n[O2]. Здесь β = 2,2∙10-24 м3/с, или, в единицах, используемых в CFD-ACE, β=1,33∙103 м3/(кмоль∙с).
16. O2- + O2* → 2O2 + e. Отлипание. Реакция описывается соотношением ω=βn[O2-]n[O2*]. Здесь β = 2∙10-16 м3/с, или, в единицах, используемых в CFD-ACE, β=1,2∙1011 м3/(кмоль∙с).
17. O- + O2+ → O + O2. Ион-ионная рекомбинация. Реакция описывается простым соотношением: ω=βn[O-]n[O2+], где β=6∙10-13 м3/кмоль∙с.
18. O- + N2+ → O + N2. Ион-ионная рекомбинация. Реакция описывается простым соотношением: ω=βn[O-]n[N2+], где β=1∙10-13 м3/кмоль∙с.
19. O2- + O2+ → 2O2. Ион-ионная рекомбинация. Реакция описывается простым соотношением: ω=βn[O2-]n[O2+], где β=4.2∙10-13 м3/кмоль∙с.
20. O2- + N2+ → O2 + N2. Ион-ионная рекомбинация. Реакция описывается простым соотношением: ω=βn[O2-]n[N2+], где β=1.6∙10-13 м3/кмоль∙с.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.