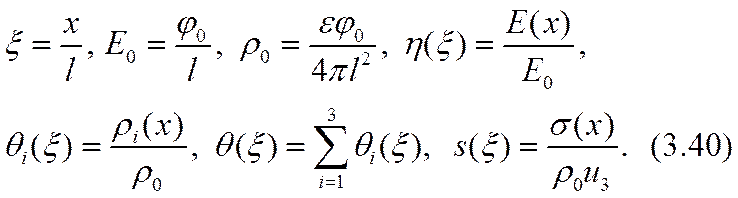
На рис. 3.1 в безразмерных переменных изображены кривые стационарного распределения плотности объемного заряда моно- и трииодида q1 (x) и q2 (x). Здесь же изображены кривые распределения плотности зарядов катиона калия q3 (x), а также и распределения суммарного объемного заряда q (x) в том же приближении. Начало координат размещено в средней плоскости ячейки. Рисунок отображает противоположность направлений градиентов концентрации обеих активных компонент электро-лита q1 (x) и q2 (x).
На рис. 3.2 изображены соответствующие кривые стационарного распределения напряженности электрического поля h (x) и удельной электропроводности электролита s (x). Кривые показывают противоположность направлений градиентов этих функций, как и у бинарных систем. Ввиду удовлетворительного соответствия опыту (см. далее § 2) полученных математических закономерностей целесообразно теперь обсудить их физическую модель. Модель предполагает настолько полную диссоциацию молекул растворенных соединений, что ассоциированные ионы в электролите практически не встречаются. Из рис. 3.1 видно, что концентрация q3 (x) пассивных
ная электропроводность раствора s (х), s (x) в ячейке («измеренная на переменном токе»), как показано на рис. 3.2 внизу: у катода она повышена, у анода — понижена. Это перераспределение проводимости влечет за собой неоднородное распределение напряженности электрического поля Е (х), h (x), как это показано на рис. 3.2 вверху.
Наряду с описанной «ионной» моделью электрохимических явлений в тернарных системах допустима в принципе и другая — «молекулярная» модель прохождения тока, которая отвечает гипотезе о ничтожной степени диссоциации молекул на ионы. Электронейтральный раствор молекул моноиодида калия обладает большой концентрацией у катода как атомов калия, так и атомов иода в ассоциированных ионах моноиодида. Только под действием градиента концентрации молекулы осмотически диффундируют к аноду. У анода жидкость превращается в электронейтральный же раствор трииодида калия, который диффундирует к катоду только осмотически. Превращение нейтральных молекул моноиодида в нейтральные молекулы трииодида освобождает индивидуальные катионы «лишнего» калия. Электронейтральность раствора нарушается в пользу положительных ионов, которые под действием электрического поля устремляются к катоду и тем осуществляют перенос положительных зарядов через ячейку. У катода они входят в состав электронейтральных молекул моноиодида, возникающих здесь из трииодида.
В этой второй модели все электронейтрально, кроме свободных катионов калия, которые участвуют в прохождении тока. При этом происходит обеднение раствора молекулами моноиодида и обогащение его молекулами трииодида калия.
Вторая модель имеет то преимущество перед первой, что не требует полноты диссоциации молекул в растворе. Результат противопоставления обеих моделей состоит в том, что знаки объемных зарядов (отклонений от первоначальной электронейтральности растворов), создаваемых протекающим током, в обеих моделях противоположны. Сильно различаются и степени диссоциации: почти полная диссоциация в первой и ничтожная во второй. Значит, исследовав экспериментально величину и знак объемных зарядов, можно в мало изученном растворе предположительно оценить степень его диссоциации. Эти вопросы заслуживают дальнейших исследований особенно в применении к слабопроводящим жидкостям.
Однако вторая модель поднимает новый вопрос о закономерностях электродиффузионных процессов при наличии ионов только одного единственного сорта — «унарная — электрохимическая система».
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.